Page 37 - Clean Room and Procecces 2020
P. 37
beschreiben, obwohl dies in vielen Fällen 24 Stunden bestimmt. Dies schließt mit ein: umfassenden klinischen Daten zur Kritikali-
nicht sinnvoll ist. • Kreislaufunterstützung in Patienten mit tät von Verunreinigungen in Art und Men-
linksventrikulärem Herzversagen (akutes ge existieren. Dies ist zum einen ethischen
Hersteller sind bisher auf sich allein gestellt Ereignis), Gesichtspunkten sowie einer mangelnden
und müssen reinheitstechnische Fragestel- • Kreislaufunterstützung in Patienten, bei
lungen im Rahmen ihrer obligatorischen denen eine Hochrisiko-PCI durchgeführt geschuldet [3].
Risikobewertung selbst bewerten. Dazu ge- wird (radialer Zugangsweg erforderlich, bis
hört, für potenzielle Verunreinigungen aus maximal 6 Stunden). In Ermangelung konkreter Daten für kardio-
dem Herstellungsprozess, die als kritisch vaskuläre Produkte in Kombination mit der
eingestuft werden, Akzeptanzkriterien fest- Zur Kreislaufunterstützung wird die 10F-RCP Forderung aus DIN EN ISO 12417-1 für kar-
zulegen. Allgemeine Hilfestellungen hierzu über eine Einführschleuse in der Femoralarte- diovaskuläre Implantate und extrakorporale
finden sich in der neuen Richtlinie VDI 2083 rie in die proximale Aorta descendens vorge- Systeme zur Festlegung einer Spezifikation
Blatt 21 „Reinheit von Medizinprodukten im schoben. Der Propeller selbst ist zum Schutz für partikuläre Verunreinigungen, ohne kon-
Herstellungsprozess“, die im Folgenden an der Aorta von einem Käfig aus Nitinol um- krete Vorgaben zu enthalten, ergibt eine wei-
einem Fallbeispiel eines Medizinprodukts geben, der nach erfolgter Positionierung der tergehende Recherche nach möglicherweise
aufgezeigt werden [3]. 10F-RCP aufgeklappt wird. Durch die Rotati- anwendbaren produktspezifischen Regel-
on des Propellers erzeugt die 10F-RCP im Aor- werken Sinn [5].
2. PRODUKTFUNKTION tenbogen eine Nachlastreduktion und einen
Zur besseren Bewertung einer Kritikalität erhöhten Perfusionsdruck in Richtung der Diese weiter gefasste Recherche für Pro-
von partikulären Verunreinigungen wird zu- viszeralen Organe, insbesondere der Nieren. dukte, die in Kontakt mit dem Blutkreislauf
nächst die Produktfunktion betrachtet. Bei kommen, liefert u. a. folgende Ergebnisse:
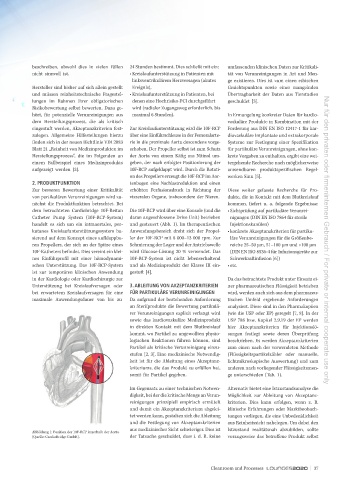
dem betrachteten Cardiobridge 10F-Reitan Die 10F-RCP wird über eine Konsole (und die • Sichtprüfung auf partikuläre Verunrei-
Catheter Pump System (10F-RCP-System) daran angeschlossene Drive Unit) betrieben nigungen (DIN EN ISO 7864 für sterile
handelt es sich um ein intraaortales, per- und gesteuert (Abb. 1). Im therapeutischen Injektionskanülen)
kutanes Kreislaufunterstützungssystem ba- Anwendungsbereich dreht sich der Propel- • konkrete Akzeptanzkriterien für partiku-
läre Verunreinigungen für die Größenbe-
sierend auf dem Konzept eines aufklappba- ler der 10F-RCP mit 8 000–13 000 rpm. Zur Übertragbarkeit der Daten aus Tierstudien Nur für den privaten oder firmeninternen Gebrauch / For private or internal cooperate use only
ren Propellers, der sich an der Spitze eines Schmierung der Lager und der Antriebswelle reiche 25–50 µm, 51–100 µm und >100 µm
10F-Katheters befindet. Dies vereint ein klei- wird Glucose-Lösung 20 % verwendet. Das (DIN EN ISO 8536-4 für Infusionsgeräte zur
nes Einführprofil mit einer hämodynami- 10F-RCP-System ist nicht lebenserhaltend Schwerkraftinfusion [6])
schen Unterstützung. Das 10F-RCP-System und als Medizinprodukt der Klasse III ein- • etc.
ist zur temporären klinischen Anwendung gestuft [4].
in der Kardiologie oder Kardiochirurgie zur Da das betrachtete Produkt unter Einsatz ei-
Unterstützung bei Kreislaufversagen oder 3. ABLEITUNG VON AKZEPTANZKRITERIEN ner pharmazeutischen Flüssigkeit betrieben
bei erwartetem Kreislaufversagen für eine FÜR PARTIKULÄRE VERUNREINIGUNGEN wird, werden auch sich aus dem pharmazeu-
maximale Anwendungsdauer von bis zu Da aufgrund der bestehenden Anforderung tischen Umfeld ergebende Anforderungen
an Sterilprodukte die Bewertung partikulä- analysiert. Diese sind in den Pharmakopöen
rer Verunreinigungen explizit verlangt wird (wie die USP oder EP) geregelt [7, 8]. In der
sowie das kardiovaskuläre Medizinprodukt USP 788 bzw. Kapitel 2.9.19 der EP werden
in direkten Kontakt mit dem Blutkreislauf hier Akzeptanzkriterien für Injektionslö-
kommt, wo Partikel zu ungewollten physio- sungen festlegt sowie deren Überprüfung
logischen Reaktionen führen können, sind beschrieben. Es werden Akzeptanzkriterien
Partikel als kritische Verunreinigung einzu- zum einen nach der verwendeten Methode
stufen [2, 3]. Eine medizinische Notwendig- (Flüssigkeitspartikelzähler oder manuelle,
keit ist für die Ableitung eines Akzeptanz- lichtmikroskopische Auswertung) und zum
kriteriums, die das Produkt zu erfüllen hat, anderen nach vorliegender Flüssigkeitsmen-
somit für Partikel gegeben. ge unterschieden (Tab. 1).
Im Gegensatz zu einer technischen Notwen- Alternativ bietet eine Istzustandsanalyse die
digkeit, bei der die kritische Menge an Verun- Möglichkeit zur Ableitung von Akzeptanz-
reinigungen prinzipiell empirisch ermittelt kriterien. Dies kann erfolgen, wenn z. B.
und damit ein Akzeptanzkriterium abgelei- klinische Erfahrungen oder Marktbeobach-
tet werden kann, gestalten sich die Ableitung tungen vorliegen, die eine Unbedenklichkeit
und die Festlegung von Akzeptanzkriterien aus Reinheitssicht nahelegen. Um dabei den
aus medizinischer Sicht schwieriger. Dies ist Istzustand realitätsnah abzubilden, sollte
Abbildung 1: Position der 10F-RCP innerhalb der Aorta
(Quelle: CardioBridge GmbH). der Tatsache geschuldet, dass i. d. R. keine vorzugsweise das betroffene Produkt selbst
Cleanroom and Processes | 37