Kalte WFI-Herstellung
Teil 1: Rahmenbedingungen und Vorgehensweise im Projekt
Maschinen- und Anlagenbau
Key Words M-WFI | Annex 15 | mikrobiologisches Monitoring | Ultrafiltration | Hygienic Design
Zusammenfassung
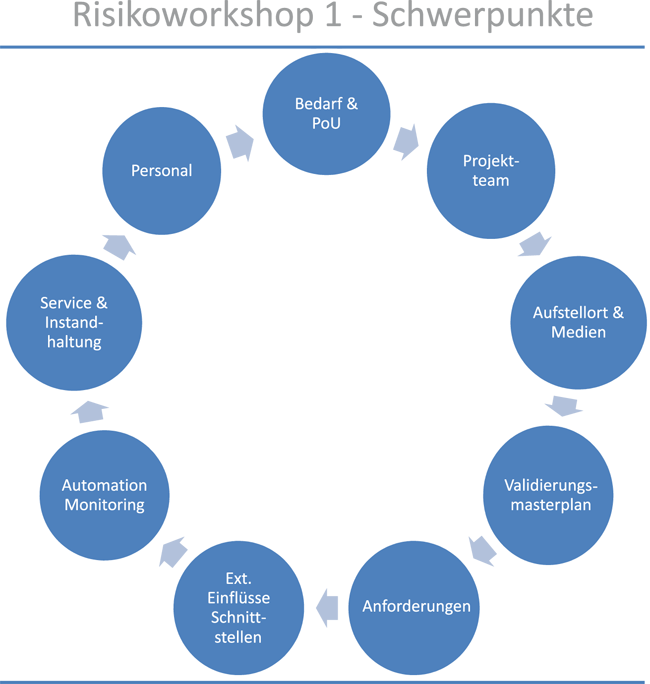
Eine Änderung in der Europäischen Pharmacopoeia macht die nicht-destillative Herstellung von kaltem Water for Injection (WFI) seit 1. Apr. 2017 möglich. Die European Medicines Agency (EMA) hat im Aug. 2017 ein Q&A-Papier als Preliminary Guideline veröffentlicht, welches Fragen und Antworten zu geeigneten Technologien und Biofilm-Kontrollstrategien bereitstellt. Dieser Beitrag beschäftigt sich mit der konkreten Implementierung der Inhalte aus dem EMA-Papier unter Einbindung des Good-Manufacturing-Practice(GMP)-Annex 15 der EU in Form der Projektierung einer alternativen WFI-Erzeugeranlage von der Risikoanalyse bis zum Factory Acceptance Test (FAT). Hierbei werden Risiken und die Chancen der alternativen Herstellungstechnik beleuchtet und ein erster Stand der Technik zur Diskussion gestellt.
Korrespondenz:
Thomas Rücker, geschäftsführender Gesellschafter, Letzner Pharmawasseraufbereitung GmbH, Robert-Koch-Str. 1, 42499 Hückeswagen; e-mail: Thomas.Ruecker@letzner.de
 | Thomas Rücker Thomas Rücker schloss im Jahr 2005 sein Masterstudium im Bereich Wirtschaftsingenieurwesen ab. Im Jahr 2007 startete er als Projektleiter bei der Letzner Pharmawasseraufbereitung GmbH, wo er 2010 intern in den Vertrieb wechselte. Seit 2015 ist er geschäftsführender Gesellschafter. |
 | Melanie Cole Melanie Cole arbeitete im Forschungslabor der Uni Köln als Biologisch-Technische |
Schließen Sie hier ein Abonnement ab und profitieren Sie von den vielseitigen Nutzungsmöglichkeiten.