Technologietransfer in der pharmazeutischen Industrie
Eine Fallstudie
Maschinen- und Anlagenbau
Key WordsTechnologietransfer | Parenteralia | Bulklösung | Aseptisch | Strömungsvisualisierung
Zusammenfassung
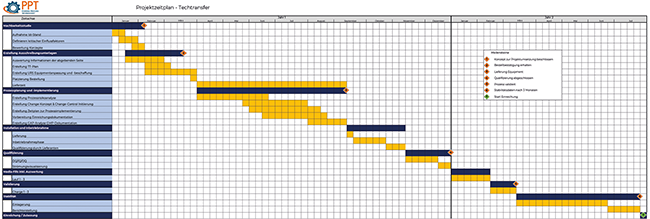
Bei sprunghaft ansteigender Nachfrage für die Herstellung von Parenteralia ist ein Technologietransfer i. d. R. zeit- und kostensparender als Neubauprojekte zur Kapazitätserweiterung. Aus diesem Grund leistet Technologietransfer entscheidende Unterstützung bzgl. der Sicherung der Marktversorgung mit wichtigen pharmazeutischen Produkten. Dieser Beitrag beschreibt die einzelnen Phasen des Technologietransfers – vom Initiieren über die Planung, Steuerung, Kontrolle bis hin zum erfolgreichen Abschluss des Prozesses. Anhand des Beispiels „Transfer einer steril gefertigten Bulklösung bis zum applizierbaren Produkt“ werden der zeitliche Ablauf, der dokumentarische Aufwand und das Risikomanagement im Projekt beleuchtet.
Weiterhin wird sowohl auf die (parallel zur Produktion stattfindende) Änderungskontrolle zur Einführung neuer Materialien, Geräte und Prozesse zur Produktion als auch auf die Qualifizierung und Validierung in Zusammenhang mit der Erteilung der behördlichen Zulassung eingegangen. Die Strömungsvisualisierung in der aseptischen Kernzone wird dabei als ein wichtiger Teil der Qualifizierung genauer betrachtet.
Korrespondenz:
Stefan Bieler, PPT Pharma Process Technology GmbH, Neue Mainzer Str. 66–68, c/o Mindspace 6. OG, 60311 Frankfurt am Main; E-Mail: info@pp-technology.de
 | Stefan Bieler Ein technisch orientiertes Studium zum Master of Science bildete die Grundlage für den bisherigen professionellen Werdegang von Stefan Bieler im Bereich der aseptischen Abfüllung und Gefriertrocknung von aktiven und inaktiven Impfstoffen. Die anschließende Auslandstätigkeit in den USA im Bereich Upstream und Downstream Manufacturing erweiterten die Kenntnisse über biotechnologische |
Schließen Sie hier ein Abonnement ab und profitieren Sie von den vielseitigen Nutzungsmöglichkeiten.