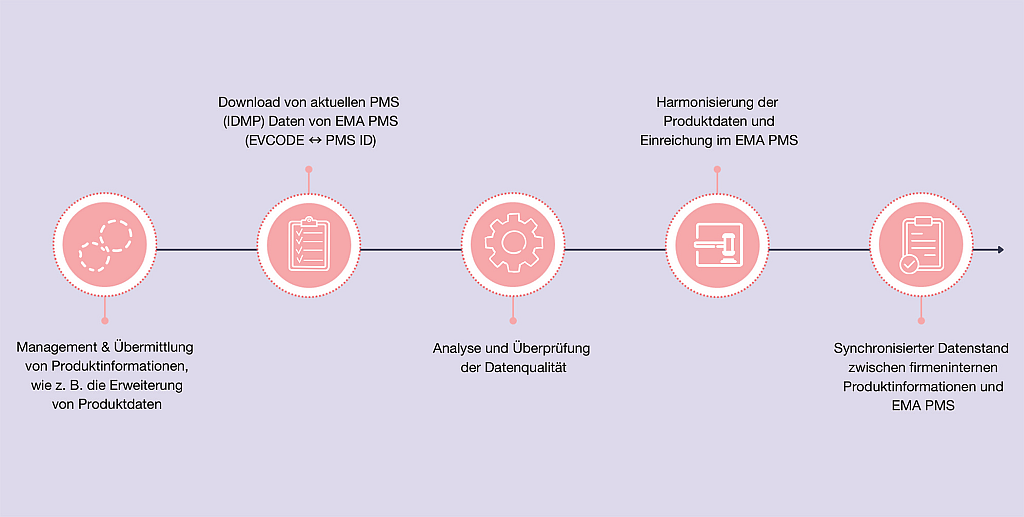
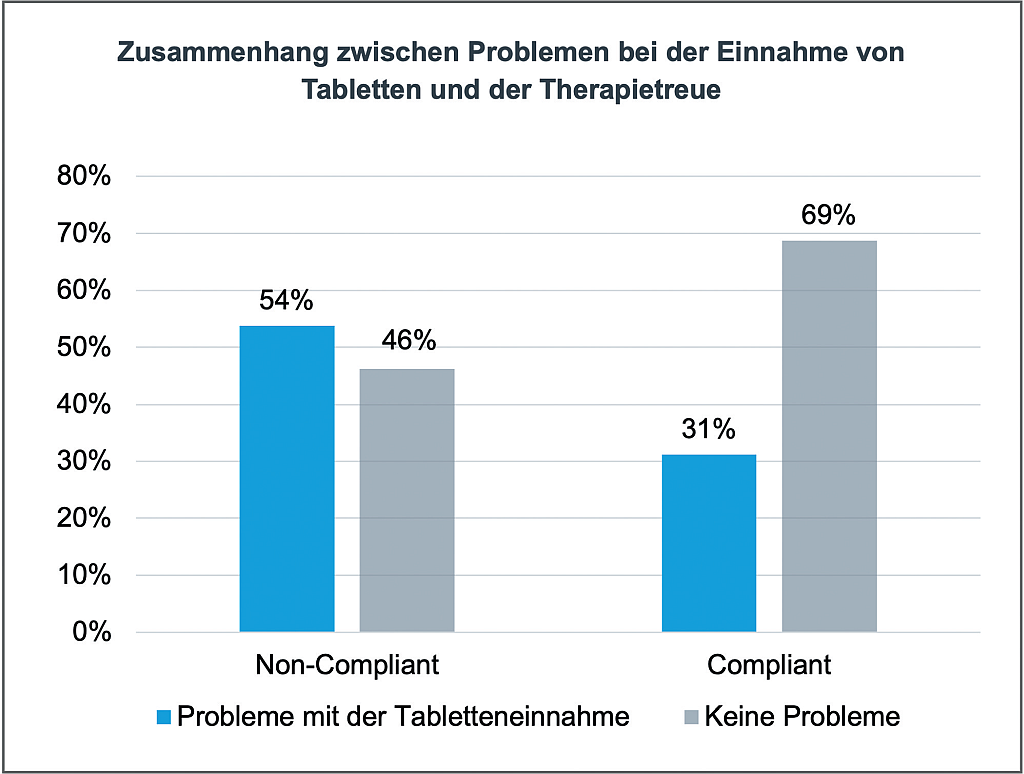
COMP – News | Beitrag aus pharmind 88 | Nr. 2 | Seite XXV-XXVI (2026)
10.03.2026Der Ausschuss für Orphan-Arzneimittel (Committee for Orphan Medicinal Products, COMP) ist ein wissenschaftliches Gremium der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA), das ...
BGH: Revision einer gegen SARS-Cov-2-geimpften Person erfolgreich
10.03.2026Dem Urteil liegt folgender Sachverhalt zugrunde: Die Klägerin macht gegen die Beklagte, ein pharmazeutisches Unternehmen und Hersteller des COVID 19 Impfstoffs Vaxzevria, Auskunfts- und ...
67 Cent mehr – und Fiebersaft war genug da
10.03.2026Ein kleiner Preissprung von nur 67 Cent pro Flasche reichte aus, um die Arzneimittelversorgung zu stabilisieren. In der Erkältungssaison 2025/26 ist die Zahl der Engpässe bei Kinderarzneimitteln ...
Lieferengpässe und Kostensteigerungen bei Arzneimitteln
09.03.2026Zum Thema Arzneimittel hat der Gesundheitsausschuss im Bundestag am Mittwoch (4. März 2026) eine öffentliche Anhörung durchgeführt. Grundlage dafür waren vier Anträge der AfD-Fraktion und ein ...
Heidelberg Pharma und HealthCare Royalty geben Änderung der bestehenden Lizenzvereinbarung und Beteiligung von Soleus Capital bekannt
10.03.2026Die Heidelberg Pharma AG, ein Entwickler innovativer Antikörper-Wirkstoff-Konjugate (ADCs), gab am 7. März eine weitere Änderung ihres bestehenden Lizenzvertrags mit HealthCare Royalty (HCRx) ...
Lonza schließt die Umwandlung zum reinen CDMO mit der Vereinbarung zum Verkauf von Kapseln und Gesundheitsinhaltsstoffen ab
10.03.2026Lonza hat eine verbindliche Vereinbarung zum Verkauf ihres Geschäftsbereichs Capsules & Health Ingredients (CHI) an Lone Star Funds („Lone Star“) zu einem Unternehmenswert von 2,3 Milliarden CHF ...
BASF führt Produktvarianten mit reduziertem CO2-Fußabdruck (rPCF) für BDO, THF, PolyTHF® und NMP ein
10.03.2026Der Unternehmensbereich Intermediates der BASF hat neue Produktvarianten mit reduziertem Product Carbon Footprint (rPCF) für Butandiol (BDO), Tetrahydrofuran (THF), Polytetrahydrofuran (PolyTHF®) ...
BDI nach Bundestagsbeschluss: „Diese Krankenhausreform ist eine Enttäuschung“
10.03.2026Anlässlich des Beschlusses zum Krankenhausreformanpassungsgesetz (KHAG) im Bundestag zeigt sich der Berufsverband Deutscher Internistinnen und Internisten e.V. (BDI) enttäuscht. Aus Sicht der ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Articles

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Preview (subject to changes)
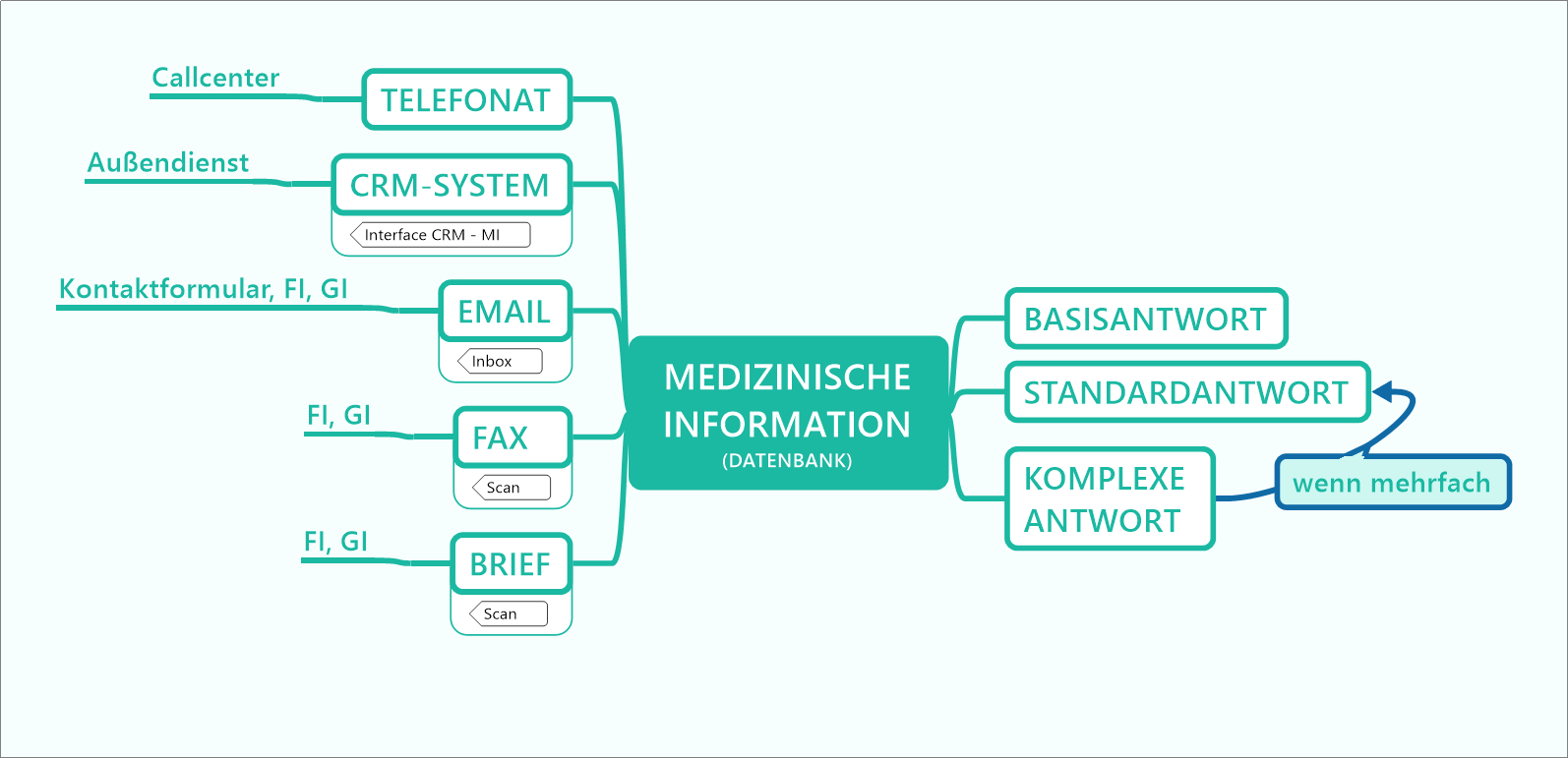
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.