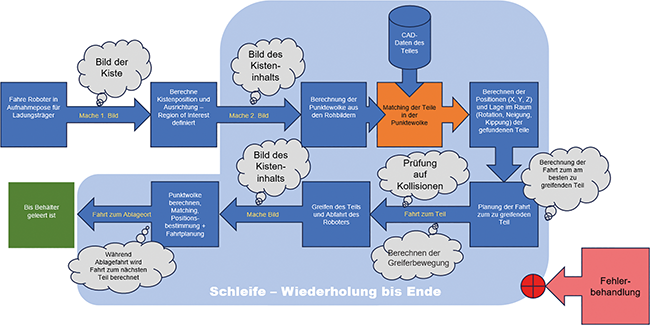
Kamerageführte Robotik | Beitrag aus Tech4Pharma 15 | Nr. 4 | Seite 234-239 (2025)
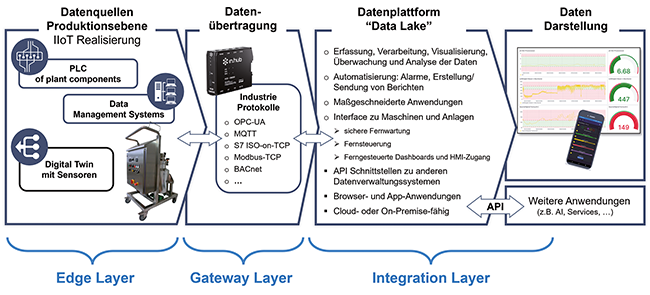
25.02.2026Der erste Teil dieses Beitrags befasste sich mit den technischen Grundlagen einer kamerageführten Robotersteuerung und betrachtete dabei die 3-D-Kameratechnologie sowie die folgende Bildverarbeitung ...
Bausch+Lomb erweitert sterile Produktion mit neuer Abfülllinie von Steriline
10.03.2026Der Augenheilkunde-Spezialist Bausch+Lomb investiert in moderne Produktionsanlagen für sterile ophthalmologische Produkte. Am italienischen Standort Macherio hat das Unternehmen eine neue Abfüll- ...
Siemens baut für über 200 Millionen Euro Zukunftsfabrik in Amberg
10.03.2026Siemens plant eine umfassende Erneuerung am Produktions- und Entwicklungsstandort Amberg. Bis 2030 entsteht dort eine intelligente Fabrik für den Geschäftsbereich Smart Infrastructure. Damit ...
35 Jahre InfraTec: Familiär geprägtes Unternehmen schafft Raum für Entwicklung
10.03.2026Der überwiegende Teil aller Unternehmen in Deutschland zählt zu den kleinen und mittleren Unternehmen (KMU). Mehr als die Hälfte aller Beschäftigten arbeitet in diesen Firmen, die ca. 40 % der ...
Bruker VERTEX NEO Ultra Tisch-FT-IR-Spektrometer
10.03.2026VERTEX NEO Ultra ist das Spitzenmodell unter den Tisch-FT-IR-Spektrometern für Vakuum und bietet höchste Auflösung, breitesten Spektralbereich, bestes Signal-Rausch-Verhältnis und volle ...
Labexchange gewinnt den Deutschen Nachhaltigkeitspreis 2026 in der Kategorie Investitionsgüter Großhandel
09.03.2026Sieger des Deutschen Nachhaltigkeitspreises 2026: Der 18. Deutsche Nachhaltigkeitspreis 2026 in der Kategorie „Investitionsgüter-Großhandel“ – ist Europas wichtigste Auszeichnung für ...
meistgelesen
Beitrag aus der Ausgabe 2/2025 der Zeitschrift Tech4Pharma
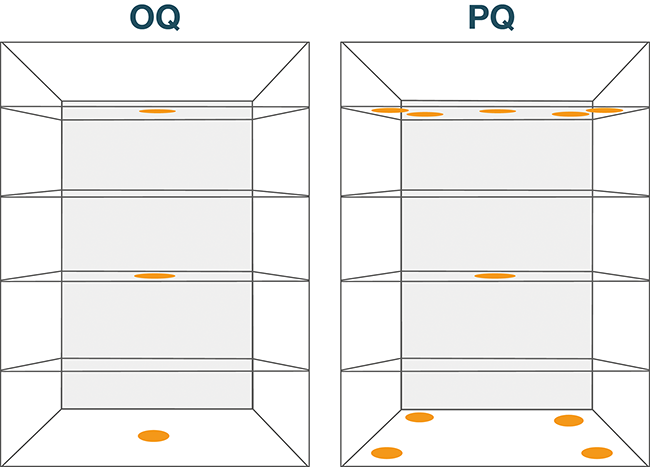
Temperaturverteilungsmessung
Herausforderungen bei einem Tieftemperatur-Mapping
Die Temperatur- und Klimaverteilungsmessung, kurz Mapping genannt, bildet das zentrale Element einer Lager- oder Transportqualifizierung. Im EU-Leitfaden zur Good Distribution Practice (GDP) [1] wird die Durchführung einer Verteilungsstudie vor Inbetriebnahme und bei wesentlichen Veränderungen unter repräsentativen Bedingungen gefordert. Die Basis dafür bildet eine entsprechende Risikobetrachtung. Näheres dazu kann in [2] nachgelesen ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
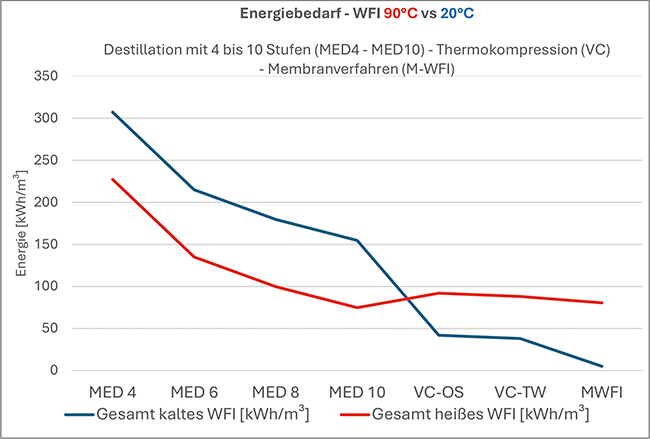
Serie: Energetische Analyse von WFI-Systemen
Teil 2*Teil 1 dieser Serie s. Tech4Pharma 2025;15(3):158–163.: WFI-Erzeugung – Auswahlkriterien und Energiebilanz
Der erste Serienteil bot einen Überblick über die gängigen Verfahren zur Herstellung von Wasser für Injektionszwecke (WFI): Mehrstufendestillation, Thermokompression und membranbasierte Systeme. Die Funktionsweise, Betriebsmöglichkeiten und energetischen Eigenschaften der Technologien wurden systematisch dargestellt. Ein besonderer Fokus lag auf Nachhaltigkeitsaspekten und integrierten Energiesparmaßnahmen.Im dritten Serienteil werden die ...
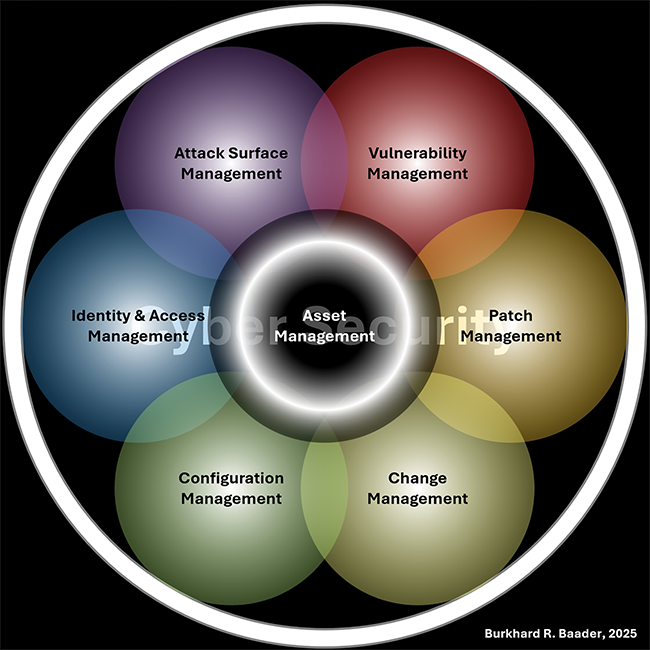
Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
The Current Draft of Annex 11
An Evaluation of Possible Consequences: Advances for Security and new Challenges for Compliance
The drafts of Annex 11 (Computerised Systems), Chapter 4 (Documentation), and the new Annex 22 (Artificial Intelligence) were jointly published on 7 July 2025 for public consultation [1].The GAMP D-A-CH Special Interest Group (SIG) Cyber Security and Resilience in GxP Environments by International Society for Pharmaceutical Engineering (ISPE) and Verein Deutscher Ingenieure e. V. (VDI) in collaboration ...
Top Themen
Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
Modellbasierte Prozessoptimierung
Diskrete Ereignissimulation am Beispiel des Puffermanagements – Teil 1
Die biopharmazeutische Industrie durchläuft derzeit einen Transformationsprozess, der maßgeblich durch den Einsatz digitaler Technologien und datenbasierter Methoden geprägt ist. In diesem Wandel etabliert sich Simulation zunehmend als zentrales Instrument zur Analyse, Optimierung und strategischen Steuerung komplexer Produktionsabläufe [1].Ein vielzitierter Beitrag zur Diskussion um die „Fabrik der Zukunft“ stammt von ...

Vorschau (Änderungen vorbehalten)

Beitrag aus der nächsten Ausgabe 1/2026 der Zeitschrift Tech4Pharma
(erscheint am 11.03.2026)
Systemintegration als Schlüssel / Sicheres und effizientes Containment in der pharmazeutischen Feststoffproduktion
Die Pharmaindustrie sieht sich mit stetig steigenden Anforderungen an Containment-Lösungen konfrontiert. Der Umgang mit hochpotenten Wirkstoffen, neue regulatorische Vorgaben und die Entwicklung immer komplexerer Produktionssysteme verlangen nach innovativen, ganzheitlich integrierten Konzepten zum Schutz von Bedienern, Produkten und Umwelt – bei gleichzeitig maximaler Effizienz. Besonders die Kombination von Continuous Manufacturing und digital vernetzter Prozessüberwachung mittels eingebetteter Prozessanalysetechnik (ePAT) setzt neue Maßstäbe für Sicherheit, Qualität und Wirtschaftlichkeit. Der aktualisierte SMEPAC-Praxisleitfaden fokussiert sich erstmals explizit auf komplexe Anlagen und den gesamten Lebenszyklus – von der Produktion über Reinigung bis zur Außerbetriebnahme. Dieser Beitrag analysiert regulatorische Veränderungen, erläutert die Rolle von Systemintegration und Transferpunkt-Minimierung und gibt praxisnahe Einblicke in die Umsetzung neuer Leitlinien und innovativer Technologien.