Wie sich der pharmazeutische Maschinenbau schon jetzt auf den neuen EU GMP Annex 1 einstellen kann
Maschinen- und Anlagenbau
Key WordsAseptik | Annex 1 | Maschinenbau | Beständigkeitsprüfungen | Hygienic Design
Zusammenfassung
Die Anforderungen von Behörden und Pharmazeuten an eine industrielle Produktion unter aseptischen Bedingungen steigen stetig. Das letztliche Ziel ist hierbei die Gewährleistung der Patientensicherheit. Die wichtigsten Anforderungen für die Produktion steriler Arzneimittel gibt der Good Manufacturing Practice (GMP) Annex 1 der Europäischen Union vor, welcher derzeit in Überarbeitung ist.
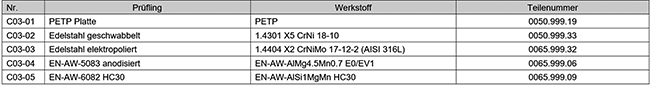
Um diese GMP-Anforderungen zu erfüllen und in einen technischen Ausführungsstandard zu übertragen, wurde ein detailliertes Konzept zu GMP-gerechtem Design für aseptische Anlagen erstellt. Dieses fasst mit dem Fokus auf aseptische Maschinen universell gültige Spezifikationen zusammen, etwa zur Sterilhaltung, Reinigbarkeit, Set-up, Hygienic Design, Material- und Oberflächenanforderungen. So wird gewährleistet, dass die pharmazeutische Produktion gemäß Annex 1 durchgeführt wird, um für den Patienten die entsprechende Sicherheit und Unbedenklichkeit zu garantieren.
Korrespondenz:
Julian Grossmann, Harro Höfliger Verpackungsmaschinen GmbH, Helmholtzstraße 4, 71573 Allmersbach i.T.; E-Mail: Julian.Grossmann@hoefliger.de
 | Karin Marek 1994 startete die studierte Chemikerin in der analytischen Methodenentwicklung bei der Gödecke AG in Freiburg und wechselte 1997 zur AZU Pharma nach Gerlingen. Am späteren Sandoz-Standort übernahm sie unterschiedliche Aufgaben in den Bereichen Pharmazeutische Entwicklung, Qualifizierung und Validierung und zuletzt die Leitung von Manufacturing Science and Technologie des Standorts. Seit Nov. 2016 |
Sie haben Tech4Pharma / cleanroom & processes für sich entdeckt und möchten auf alle Beiträge und Ausgaben Zugriff haben?
Dann registrieren Sie sich noch heute kostenlos und genießen Sie sofort alle Möglichkeiten – recherchieren, lesen, downloaden.