COMP – News | Beitrag aus pharmind 88 | Nr. 1 | Seite XII-XIII (2026)
13.02.2026Der Ausschuss für Orphan-Arzneimittel (Committee for Orphan Medicinal Products, COMP) ist ein wissenschaftliches Gremium der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA), das ...
Roche begeht feierliche Einweihung des neuen Diagnostik-Innovationszentrums „LEAP“ in Penzberg
13.02.2026Nach rund vierjähriger Bauzeit ist in Penzberg ein neues Diagnostik-Innovationszentrum entstanden – ein modernes, nachhaltiges Gebäude, in das Roche rund 300 Millionen Euro investiert hat. Unter ...
TrumpRx: Pharma Deutschland warnt vor Folgen
13.02.2026In der vergangenen Woche startete US-Präsident Donald Trump seine Plattform TrumpRx, die den Amerikanern den Zugang zu Vergünstigungen bei teuren Arzneimitteln verschaffen soll. Das setzt auch die ...
Kompetenzzentrum für Gefriertrocknung
13.02.2026Gemeinsam mit NRW-Wirtschaftsministerin Mona Neubaur hat Stefan Klebert, CEO von GEA, ein neues Technologiezentrum für pharmazeutische Gefriertrocknungssysteme im nordrhein-westfälischen Elsdorf ...
Envirofalk erweitert Fertigungsstandort Leverkusen für Pharmawasseraufbereitung
13.02.2026Mit einem symbolischen Mauerdurchbruch hat Envirofalk Pharmawatersystems die Erweiterung des Standorts Leverkusen eingeleitet. Die Geschäftsführung entschied sich bewusst gegen den klassischen ...
Mehr Arzneimittelstudien für die Menschen in Deutschland
13.02.2026Innovationen made in Germany: Das war einmal. Oder nicht? Im Bereich der pharmazeutischen Forschung könnte sich dank politischer Maßnahmen wie dem Medizinforschungsgesetz das Blatt wieder wenden. ...
Waters schließt Fusion mit BD-Sparten ab
13.02.2026Die Waters Corporation gab bekannt, dass sie den bereits angekündigten Zusammenschluss mit dem Geschäftsbereich Biosciences & Diagnostic Solutions von Becton, Dickinson and Company abgeschlossen ...
Sanofi übernimmt Dynavax
13.02.2026Sanofi gab bekannt, dass es die Übernahme der Dynavax Technologies Corporation (Dynavax) abgeschlossen hat. Die Übernahme umfasst den Hepatitis-B-Impfstoff HEPLISAV-B von Dynavax für Erwachsene, ...
Konsolidierung der Krankenkassenfinanzen – Zu viele Vorschläge, zu viel Verunsicherung
13.02.2026Angesichts der aktuellen Diskussionen über die Krankenkassenfinanzen warnt Bundesärztekammer-Präsident Dr. Klaus Reinhardt, dass die Vielzahl und unkoordinierte Veröffentlichung von Vorschlägen ...
Merck senkt durch KI-Einsatz Energieverbrauch bei industrieller Kühlung deutlich
13.02.2026Industrielle Kühlanlagen zählen in der pharmazeutischen Produktion zu den größten Energieverbrauchern. Vor diesem Hintergrund untersucht Merck am Stammsitz in Darmstadt neue Ansätze zur ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
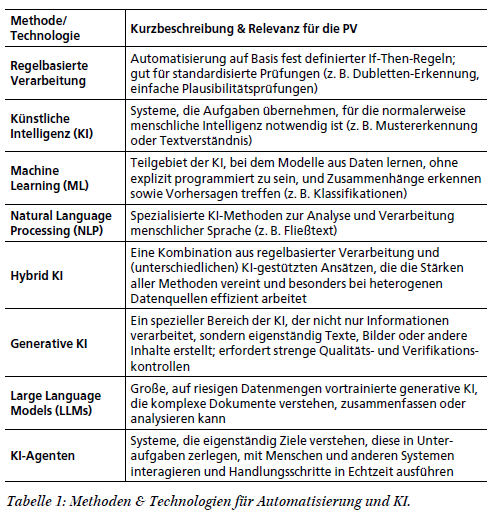
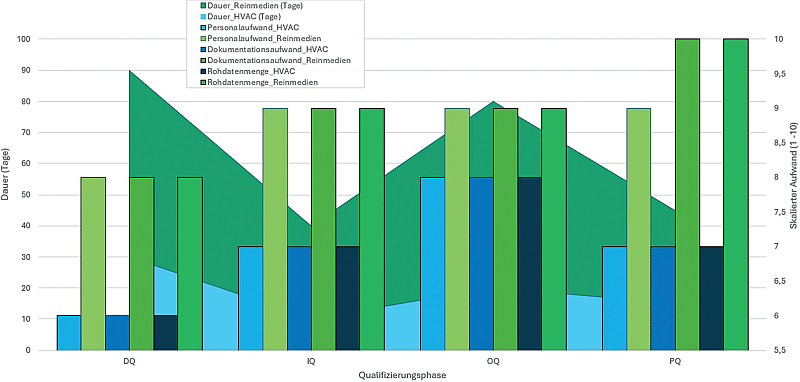
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen
Beitrag aus der Ausgabe 1/2026 der Zeitschrift pharmind
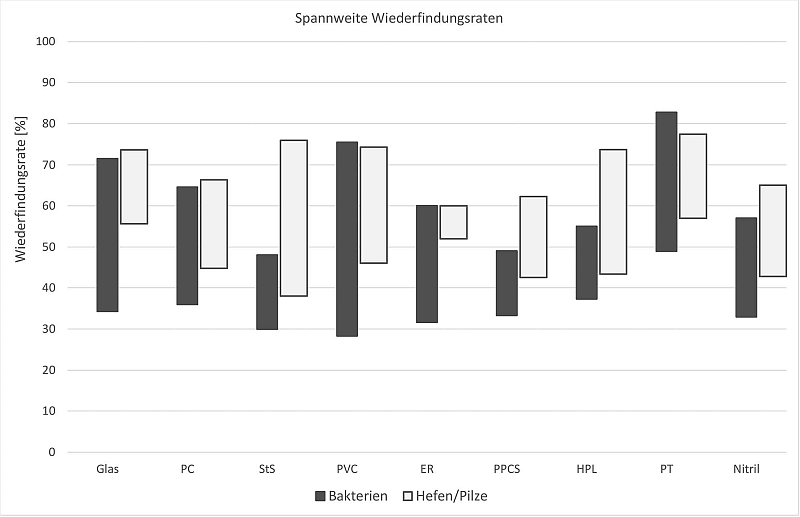
Demaskierung von Endotoxinen
Am Beispiel einer QC-Standzeit-Validierung eines biotechnologischen Pharmaunternehmens
Endotoxine sind toxische Bestandteile der äußeren Zellmembran von gramnegativen Bakterien und werden bei deren Absterben oder Zerfall freigesetzt, was zu starken Immunreaktionen wie Fieber und Entzündungen beim Menschen führen kann. Diese Bestandteile, auch Lipopolysaccharide genannt, können schon in geringsten Konzentrationen biologische Wirkungen hervorrufen und stellen somit ein erhebliches Risiko dar, insbesondere bei der Herstellung von ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 2/2026 der Zeitschrift pharmind
(erscheint am 27.02.2026)
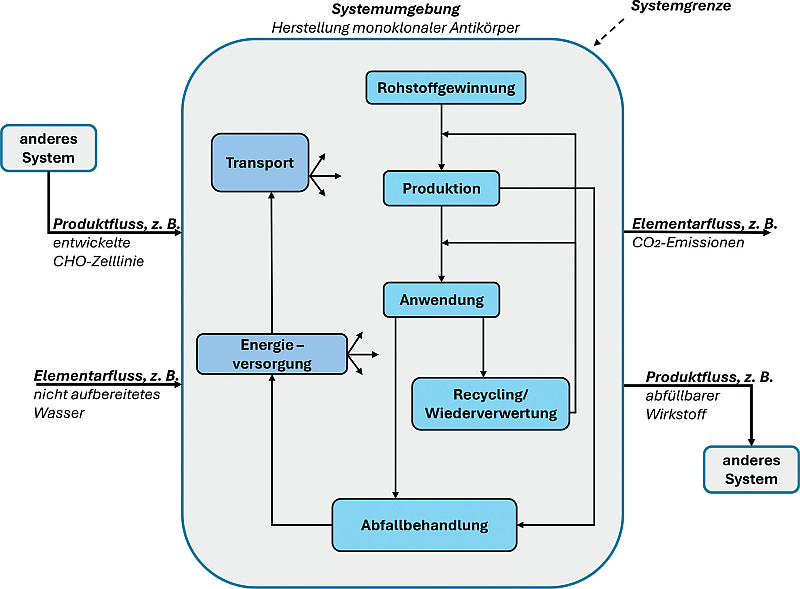
Single vs. Multi Use in Biopharma | Vergleich der Wirkstoffherstellung unter Nachhaltigkeits-Gesichtspunkten
Biopharmazeutisch hergestellte Arzneimittel dominieren zunehmend den Pharmamarkt. Bei deren Wirkstoffherstellung setzt man vermehrt auf Single Use Technology (SUT), da diese das Kreuzkontaminationsrisiko und den Ressourcenaufwand effektiv reduziert. Dagegen erweist sich Multi Use Technology (MUT) in einem flexiblen Produktionsumfeld als weniger geeignet. Bei genauer Betrachtung ergibt sich ein weiterer paradox wirkender Vorteil der SUT: ihre Umweltfreundlichkeit.