CHMP – News | Beitrag aus pharmind 88 | Nr. 2 | Seite XV-XXIV (2026)
09.03.2026Der Ausschuss für Humanarzneimittel (Committee for Medicinal Products for Human Use, CHMP) ist ein wissenschaftliches Gremium der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA) ...
Lieferengpässe und Kostensteigerungen bei Arzneimitteln
09.03.2026Zum Thema Arzneimittel hat der Gesundheitsausschuss im Bundestag am Mittwoch (4. März 2026) eine öffentliche Anhörung durchgeführt. Grundlage dafür waren vier Anträge der AfD-Fraktion und ein ...
Bundesregierung ist am Zug
09.03.2026Die Länderchefs fordern Entlastungen für die Chemie und einen Industriestrompreis. Jetzt sind schnelle Reformen nötig.
WiDi Pharma Deutschland: Nutzertreffen zum 20jährigen Bestehen des Serviceprojekts „Gemeinschaftliche Pharmakovigilanz (PV)-Datenbank“
09.03.2026Am 5. März 2026 trafen sich über 40 Projekt-Mitglieder der Gemeinschaftlichen PV-Datenbank unter saph?us® bei strahlendem Sonnenschein in unserer Geschäftsstelle in Bonn. Einleitend warf Dr. ...
Phagro – Stellungnahme zum Gesetzentwurf der Bundesregierung – Entwurf eines Gesetzes zur Weiterentwicklung der Apothekenversorgung
06.03.2026Der PHAGRO | Bundesverband des pharmazeutischen Großhandels e. V. bedankt sich für die Möglichkeit zur Stellungnahme zum Entwurf der Bundesregierung eines Gesetzes zur Weiterentwicklung der ...
AMW GmbH: Neue Gesellschafter und erneuter Rekordumsatz untermauern langfristige Wachstumsstrategie
09.03.2026Die AMW GmbH, ein Spezial-Pharmaunternehmen, das sich auf biologisch abbaubare Systeme zur kontrollierten Arzneimittelverabreichung (Drug Delivery Systems) spezialisiert hat, gab heute einen Wechsel ...
Idorsia Pharmaceuticals: Schlafstörungen verursachen jährlich 106 Milliarden Euro Kosten in Deutschland
09.03.2026Schlafstörungen sind weit verbreitet - und werden dennoch häufig unterschätzt. Die nun veröffentlichte Analyse macht deutlich, welche Dimension das Problem in Europa angenommen hat: Bis zu jeder ...
Galimedix Therapeutics wird auf der AD/PD™ 2026 Konferenz vielversprechende präklinische Daten mit einem oralen Amyloid-beta-Aggregationsmodulator der nächsten Generation präsentieren
09.03.2026Galimedix Therapeutics, Inc., ein Biotechnologieunternehmen in der klinischen Phase 2, das neuartige orale und topische neuroprotektive Therapien mit dem Potenzial zur Revolutionierung der Behandlung ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
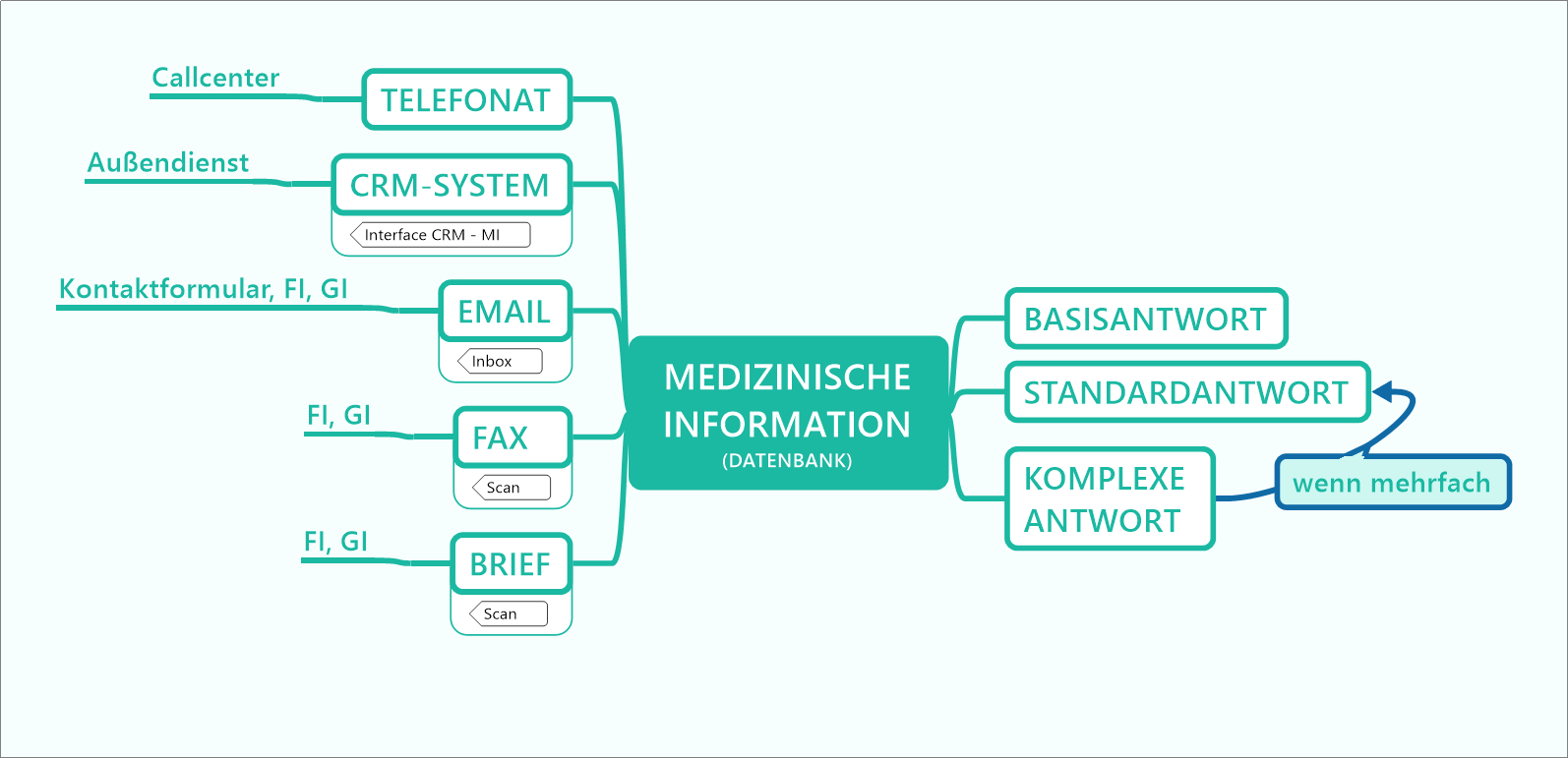
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.