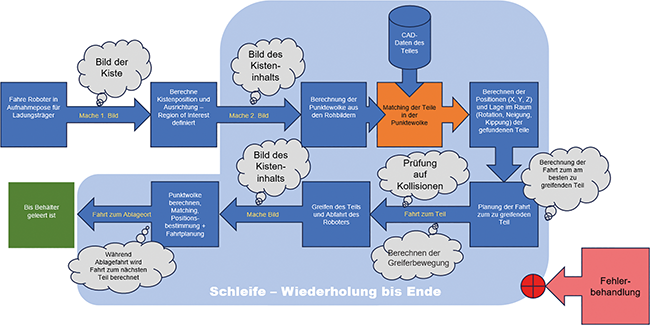
Kamerageführte Robotik | Beitrag aus Tech4Pharma 15 | Nr. 4 | Seite 234-239 (2025)
25.02.2026Der erste Teil dieses Beitrags befasste sich mit den technischen Grundlagen einer kamerageführten Robotersteuerung und betrachtete dabei die 3-D-Kameratechnologie sowie die folgende Bildverarbeitung ...
Was Europas Labore lähmt und welche Hebel Wirkung entfalten
11.03.2026Noch nie war die Bereitschaft zur Veränderung in Europas Laboren so ausgeprägt – und noch nie wurden Labormitarbeitende so stark ausgebremst. Das zeigt das neue Starlab Stimmungsbarometer 2026, ...
VDMA gründet Europäischen Landesverband Benelux
11.03.2026Der VDMA hat seinen ersten länderübergreifenden europäischen Landesverband gegründet. Erste Vorstandsvorsitzende des VDMA Benelux ist Dr. Theresa Spaan-Burke, ihr zur Seite stehen Hans van Reusel ...
KHS: Von der Verpackung zur Linie
12.03.2026Die KHS Gruppe definiert Linien- und Verpackungskompetenz neu: Auf der interpack in Düsseldorf demonstriert der Dortmunder Anlagenbauer vom 7. bis zum 13. Mai die Vorzüge perfekt aufeinander ...
LGI erweitert den Vorstand
11.03.2026Mit Wirkung zum 1. Januar 2026 verstärkt die LGI Logistics Group International GmbH ihr Managementteam in drei Schlüsselbereichen. Neben der bestehenden Führungsriege – Florian Beck (CEO), ...
Maschinenbauer GEA wächst profitabel, erreicht Klimaziele vorzeitig und erwartet beschleunigtes Wachstum für 2026
11.03.2026Deutliches Wachstum und eine weiter steigende Profitabilität prägten das abgelaufene Geschäftsjahr von GEA. Speziell beim Auftragseingang konnte der Technologiekonzern erheblich zulegen. Dazu ...
meistgelesen
Beitrag aus der Ausgabe 2/2025 der Zeitschrift Tech4Pharma
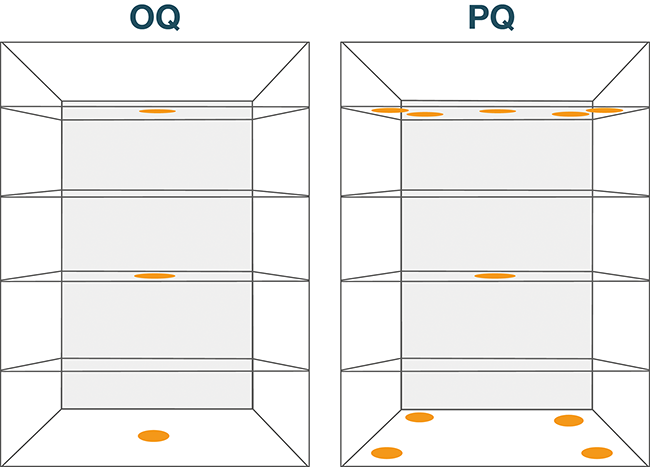
Temperaturverteilungsmessung
Herausforderungen bei einem Tieftemperatur-Mapping
Die Temperatur- und Klimaverteilungsmessung, kurz Mapping genannt, bildet das zentrale Element einer Lager- oder Transportqualifizierung. Im EU-Leitfaden zur Good Distribution Practice (GDP) [1] wird die Durchführung einer Verteilungsstudie vor Inbetriebnahme und bei wesentlichen Veränderungen unter repräsentativen Bedingungen gefordert. Die Basis dafür bildet eine entsprechende Risikobetrachtung. Näheres dazu kann in [2] nachgelesen ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
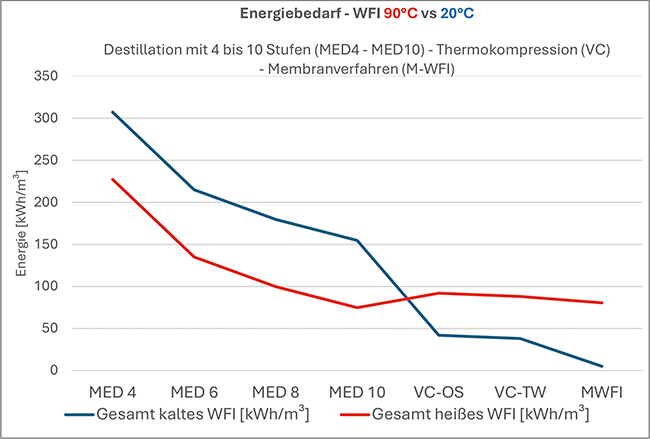
Serie: Energetische Analyse von WFI-Systemen
Teil 2*Teil 1 dieser Serie s. Tech4Pharma 2025;15(3):158–163.: WFI-Erzeugung – Auswahlkriterien und Energiebilanz
Der erste Serienteil bot einen Überblick über die gängigen Verfahren zur Herstellung von Wasser für Injektionszwecke (WFI): Mehrstufendestillation, Thermokompression und membranbasierte Systeme. Die Funktionsweise, Betriebsmöglichkeiten und energetischen Eigenschaften der Technologien wurden systematisch dargestellt. Ein besonderer Fokus lag auf Nachhaltigkeitsaspekten und integrierten Energiesparmaßnahmen.Im dritten Serienteil werden die ...
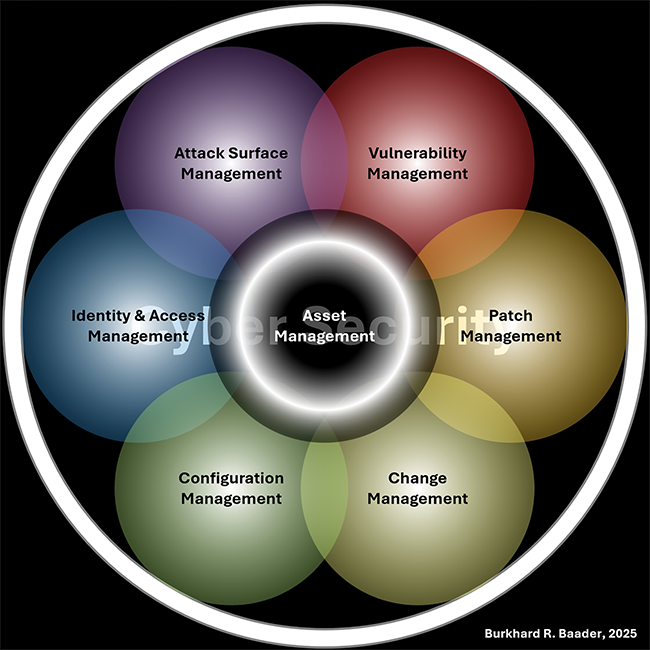
Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
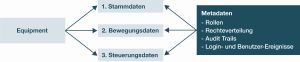
The Current Draft of Annex 11
An Evaluation of Possible Consequences: Advances for Security and new Challenges for Compliance
The drafts of Annex 11 (Computerised Systems), Chapter 4 (Documentation), and the new Annex 22 (Artificial Intelligence) were jointly published on 7 July 2025 for public consultation [1].The GAMP D-A-CH Special Interest Group (SIG) Cyber Security and Resilience in GxP Environments by International Society for Pharmaceutical Engineering (ISPE) and Verein Deutscher Ingenieure e. V. (VDI) in collaboration ...
Top Themen
Beitrag aus der Ausgabe 1/2026 der Zeitschrift Tech4Pharma
Systemintegration als Schlüssel
Sicheres und effizientes Containment in der pharmazeutischen Feststoffproduktion
Die pharmazeutische Industrie steht vor immer komplexeren und weiter steigenden Anforderungen an die Sicherheit ihrer Produktionsprozesse. Besonders der Umgang mit hochaktiven Substanzen (Highly Potent Active Pharmaceutical Ingredients, HPAPIs) verlangt nach ausgefeilten Schutzmaßnahmen. Fortschritte in Onkologie und Präzisionsmedizin sorgen dafür, dass HPAPIs (die bereits in kleinsten Mengen wirken) zunehmend eingesetzt werden. Diese Substanzen ...

Vorschau (Änderungen vorbehalten)

Beitrag aus der nächsten Ausgabe 2/2026 der Zeitschrift Tech4Pharma
(erscheint am 22.04.2026)
Modular matrix production / Future prospects for cell and gene therapies
The modular platform concept for cell and gene therapy presented in this article combines closed process modules (cubes) with innovative interface technology (AsepticGate). An initial proof of concept demonstrated the approach's process reliability and biological functionality. The concept offers a scalable solution for standardizing and automating individual manufacturing processes in cell and gene therapy, with the prospect of integration into existing Good Manufacturing Practice (GMP) structures and the path to fully automated production.