Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Krumbein F.
In der Rubrik Zeitschriften haben wir 3 Beiträge für Sie gefunden
-
High Voltage Leak Detection: Einfluss auf die Qualität von Biopharmazeutika
Rubrik: Originale
(Treffer aus pharmind, Nr. 01, Seite 114 (2019))
Scherer N | Ruthig P | Castelanelli M | Krüger T | Marcsekova K | Krumbein F | Cataldo P | Posset T
High Voltage Leak Detection: Einfluss auf die Qualität von Biopharmazeutika / Integritätsprüfung des Primärpackmittels steriler Arzneiformen mittels Hochspannung · Scherer N, Ruthig P, Castelanelli M, Krüger T, Marcsekova K, Krumbein F, Cataldo P, Posset T · Roche Diagnostics GmbH, Mannheim und und
High Voltage Leak Detection Container Closure Integrity Proteinoxidation/-denaturierung Ozon Temperaturanstieg Die Integrität von Primärverpackungen (CCI) parenteraler Lösungen ist von wesentlicher Bedeutung für die Qualität des sterilen Produkts. Durch eine integre Verpackung wird einerseits vor Verlust von Produkt und anderseits vor Kontaminationen von außen, durch eintretende Mikroorganismen, Gase und Schmutz geschützt. Um die Sicherheit des Patienten zu gewährleisten, wird daher zusätzlich zur Stabilitätsprüfung des Produkts eine 100-%-Dichtigkeits-Überprüfung gefordert [ 1 ]. Für diese von den Aufsichtsbehörden in den Vereinigten Staaten [ 2 ] und der Europäischen Union [ 3 ] vorgegebene vollständige Überprüfung ist eine zerstörungsfreie Messmethode vonnöten. Hierfür werden aktuell ...
-
Ermittlung des Energieeintrags durch optische Strahlungsquellen
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 04, Seite 230 (2017))
Ermittlung des Energieeintrags durch optische Strahlungsquellen / Ein Konzept für Arzneimittel in der parenteralen Produktion – Teil 2 * Teil 1 dieses Beitrags ist erschienen in TechnoPharm 7, Nr. 3, 164-169 (2017). · Krumbein F, Posset T · Roche Diagnostics GmbH, Mannheim
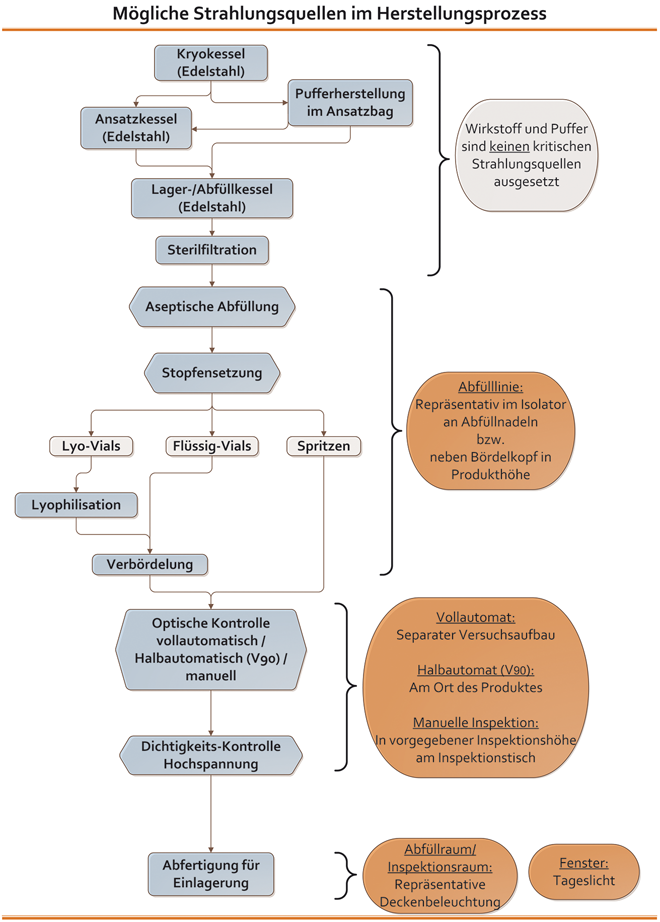
Im Zuge der Evaluierung wird für jeden Abschnitt des Herstellprozesses repräsentativ eine Messstelle festgelegt und die Strahlung gemessen. Die Orte der Messungen sind dabei so gewählt, dass alle Produktionsabschnitte sowie die spezifischen Strahlungsquellen exemplarisch betrachtet und bewertet werden. Eine Übersicht zu einem typischen Standard-Herstellungsprozess mit den einzelnen Produktionsabschnitten ist in Abb. 7 schematisch gezeigt. Die Ansatz- und Abfüllkessel bestehen oft aus Edelstahl, so dass das Produkt vor jeglicher Belastung durch Strahlung geschützt ist. Somit stellt die Abfüllung im Isolator oder Restricted Access Barrier System (RABS) den ersten Herstellschritt dar, in dem das Produkt potenziellen Strahlungsquellen ausgesetzt sein kann. Ab diesem Zeitpunkt ...
-
Ermittlung des Energieeintrags durch optische Strahlungsquellen
Rubrik: Automation
(Treffer aus TechnoPharm, Nr. 03, Seite 164 (2017))
Ermittlung des Energieeintrags durch optische Strahlungsquellen / Ein Konzept für Arzneimittel in der parenteralen Produktion – Teil 1 · Krumbein F, Posset T · Roche Diagnostics GmbH, Mannheim
Energie Strahlungsquellen Arzneimittel Optik UV-Strahlung Im Herstellungsprozess parenteraler Arzneiformen lassen sich verschiedene Strahlungsquellen aufzeigen, die auf das Produkt einwirken können. Diese beinhalten die Umgebungsbeleuchtung, das Tageslicht oder optische Inspektionseinrichtungen, welche Strahlung in differenzierten Energieformen auf das Produkt abgeben. Der Energieeintrag durch Strahlungsbelastung, dem die Arzneimittel während der Produktion ausgesetzt sind, kann zu molekularen Veränderungen sowohl bei den Wirkstoffen als auch bei den Hilfsstoffen führen. Insbesondere Proteine können verschiedene durch optische Strahlung verursachte Veränderungen aufweisen, wobei diese sowohl von der vorliegenden Proteinstruktur als auch von der Zusammensetzung der Produktlösung abhängen. Dies kann Aggregatbildung und Ausfällung zur Folge haben. Auch andere Eigenschaften ...