Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Stäudle B.
In der Rubrik Zeitschriften haben wir 2 Beiträge für Sie gefunden
-
Validierungsdokumente generieren statt schreiben
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 05, Seite 352 (2012))
Validierungsdokumente generieren statt schreiben / Stäudle • Validierungsdokumente · Stäudle B · HEITEC AG, Crailsheim
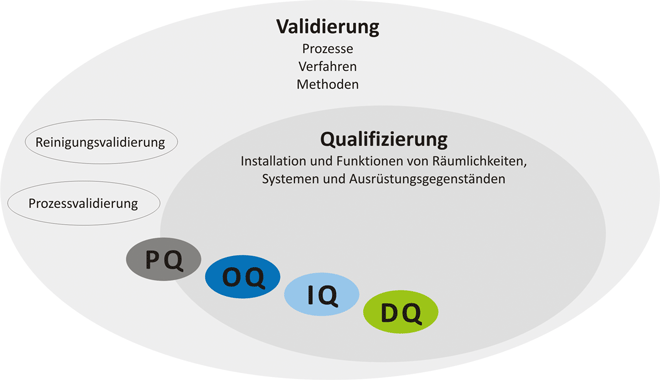
Validierung ist laut EU GMP die Beweisführung, dass in Übereinstimmung mit den Grundsätzen der Guten Herstellungspraxis Verfahren, Prozesse, Ausrüstungsgegenstände, Materialien, Arbeitsgänge oder Systeme tatsächlich zu den erwarteten Ergebnissen führen. [ 1 ] Die grundsätzliche Vorgehensweise von Planung, Spezifizierung, Umsetzung, Verifizierung und Bericht wird durch unterstützende Prozesse wie Risikomanagement, Änderungsmanagement und Dokumentenmanagement begleitet. Zur Sicherstellung der erforderlichen Qualität von Healthcare-Produkten unterliegt die Einhaltung der gültigen Gesetze und Verordnungen der behördlichen Überwachung. Spezifikationen müssen genau, fehlerfrei und aktuell sein. Validierungsumfang- und ‐tiefe werden auf Basis von Risikobewertungen festgelegt. Verifikationstests weisen nach, dass Anforderungen und Funktionalitäten von Systemen erfüllt werden ( Abb. 1 ). ...
-
Qualifizierungsanforderungen für Maschinen- und Anlagenbauer in der Pharmaindustrie
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 118 (2012))
Qualifizierungsanforderungen für Maschinen- und Anlagenbauer in der Pharmaindustrie / Stäudle und Stark • Qualifizierungsanforderungen · Stäudle B, Stark R · HEITEC AG, Crailsheim
Die industrielle Fertigung von Arzneimitteln begann Ende des 19. Jahrhunderts. Durch die großtechnische Produktion stieg auch das Risiko der Schädigung einer größeren Zahl von Menschen. Der erste folgenreiche Vorfall war 1937 die so genannte Sulfanilamid-Katastrophe in den USA: Durch die falsche Mischung von Zutaten für einen Hustensaft kamen mehr als 100 Menschen zu Tode, darunter viele Kinder. Dies war der Auslöser für die staatliche Überwachung und Zulassung von Arzneimitteln in den USA. [ 1 ] In Deutschland wurde 1961 das erste Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz, kurz AMG) ausgefertigt. Im gleichen Zeitraum wurde bekannt, dass das Schlafmittel Contergan ...