Im Spannungsfeld zwischen GMP und Biosicherheit | Beitrag aus cleanroom & processes 4 | Nr. 4 | 207-213 (2025)
18.02.2026Während bei der biotechnologischen Entwicklung und Produktion der meisten pharmazeutischen Wirkstoffe prinzipiell die Biosicherheitsmaßnahmen auf das Vermeiden einer Freisetzung genetisch ...
Quadratischer Allrounder: Ultraschallsensor der Serie UB*-F42 mit IO-Link
25.02.2026Mit der Serie UB*-F42 ergänzt Pepperl+Fuchs sein breites Ultraschallsensorik-Portfolio um einen Allrounder, der für unterschiedlichste Anwendungen geeignet ist: Er kann Objekte erkennen, ...
Robotik- und Automationsbranche weiter unter Druck
24.02.2026Die Robotik- und Automationsbranche in Deutschland befindet sich weiterhin in schwierigem Fahrwasser. Für das Jahr 2026 erwartet der Fachverband VDMA Robotik + Automation einen Umsatzrückgang von 5 ...
Neuer Elis Cleanroom-Standort in Mannheim feiert Grand Opening
19.02.2026Am vergangenen Donnerstag fand am neuen Elis Cleanroom Standort in Mannheim das Grand Opening mit Geschäftspartnern, Kunden und Pressevertreter*innen statt. Im Rahmen geführter Rundgänge wurde die ...
meistgelesen
Beitrag aus der Ausgabe 3/2025 der Zeitschrift cleanroom & processes
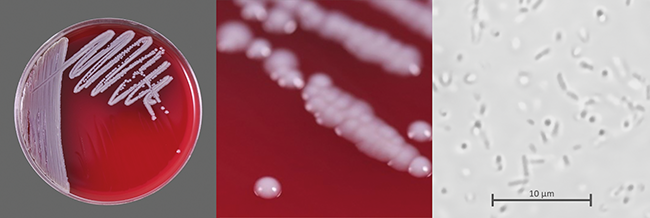
Filtergängige Bakterien
Risiko bei der aseptischen Herstellung
Die Sterilfiltration ist ein kritischer Prozess in der aseptischen Herstellung steriler Produkte, dessen Ziel die Entfernung von Mikroorganismen ist. Eine verbreitete Annahme ist, dass ein intakter Filter grundsätzlich alle Mikroorganismen zurückhält. Es gibt aber sehr wohl Mikroorganismen, die unter gewissen Umständen auch einen intakten und Pre-Use-Post-Sterilisation-Integrity-Testing(PUPSIT)-geprüften Filter passieren können. Biologische ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
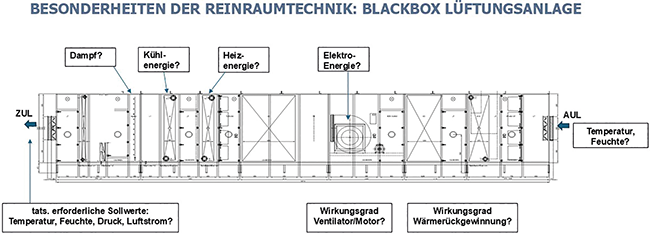
Energieeffizienz in der Reinraumtechnik
Die neue Richtlinie VDI 2083-4.2
Die Reinraumtechnik ist besonders energieintensiv. Zur Schaffung von kontrollierten Umgebungsbedingungen wie Partikelkonzentration, Temperatur, Feuchte und Druck sind oft große Luftmengen in hoher Aufbereitungsqualität erforderlich. Entsprechend hoch ist der Energiebedarf von Reinräumen.Die Energiebedarfe von reinraumtechnischen Anlagen überschreiten diejenigen von Wohn- und Verwaltungsgebäuden um ein Vielfaches. Während jedoch bei Wohn- und ...
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
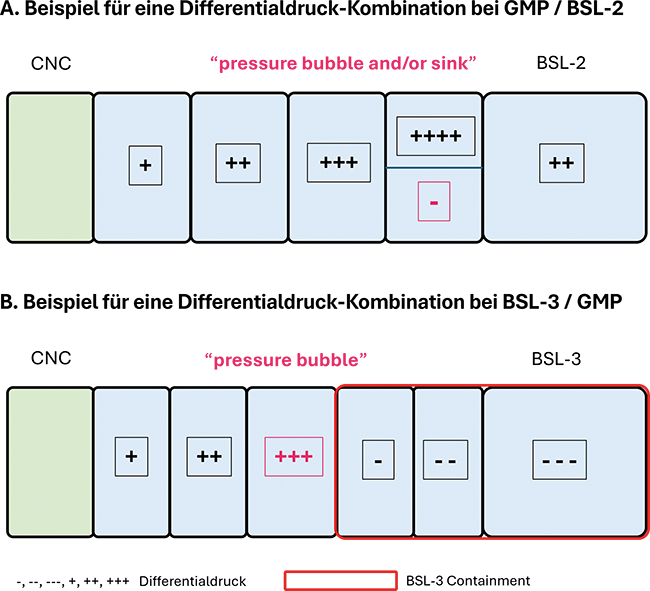
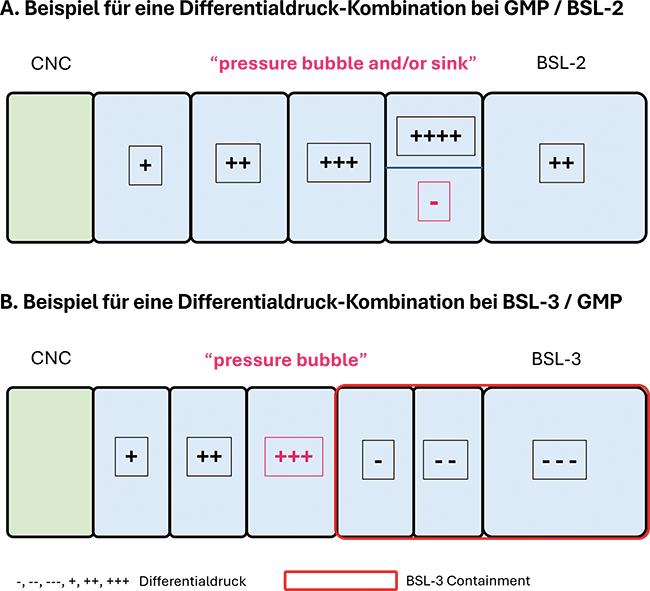
Im Spannungsfeld zwischen GMP und Biosicherheit
Die Biosicherheit in der pharmazeutischen Industrie
Im Rahmen der guten Herstellungspraxis (GMP) stehen hohe Anforderungen an den Produktschutz im Vordergrund. Dadurch fallen bei Biosicherheitsstufe 1 (BSL-1) die generellen Biosicherheitsmaßnahmen während des Produktionsprozesses trotz unterschiedlicher Zielsetzung kaum ins Gewicht. Sie lassen sich meist einfach umsetzen und sind oft durch GMP-Maßnahmen mit abgedeckt.Die Herausforderungen der Biosicherheit auf der Stufe BSL-1 liegen in ...
Top Themen
Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
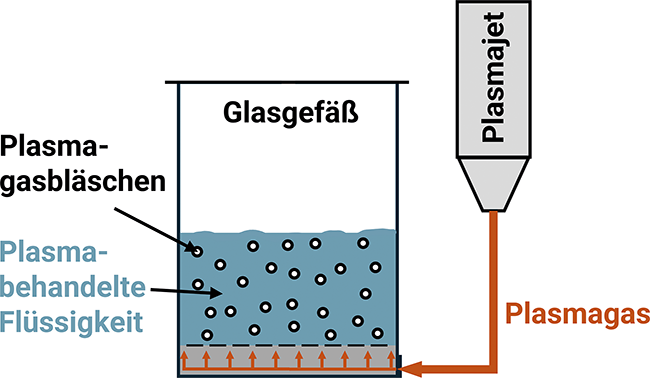
Plasmabehandelte Flüssigkeiten
Hygienische Reinigung anspruchsvoller Bauteile und Oberflächen
Reinräume sind speziell kontrollierte Umgebungen für die Entwicklung und Herstellung hochsensibler Produkte. Die Reinraumumgebung ermöglicht die Einhaltung regulatorischer Anforderungen und effiziente Herstellungsprozesse. Durch den Reinraum werden Umgebungsbedingungen geschaffen, indem das Kontaminationsrisiko für Produkte durch Prozesse und Produktlogistik minimiert wird. Entscheidende Bedeutung haben Reinräume in Branchen wie der ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 01/2026 der Zeitschrift cleanroom & processes
(erscheint am 17.03.2026)
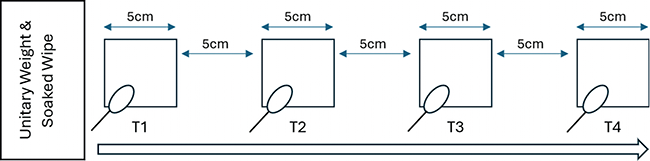
Richtiges Ankleiden und Verhalten im Reinraum – Ein Schlüssel für die Produktqualität
Der Mensch stellt im Reinraum die größte Kontaminationsquelle in sensiblen Branchen wie Pharma-, Halbleiter- oder Medizintechnikproduktion dar. Geschulte Mitarbeiter tragen täglich eine große Verantwortung für die Einhaltung der richtigen Ankleideprozedur sowie für das korrekte Verhalten im Reinraum. Ein geeignetes Bekleidungskonzept kann über Messungen der Partikelwerte mittels Body Box erfasst werden und stellt die Grundlage für eine mögliche Leistungsqualifizierung dar.
Neben dem korrekten Ankleiden ist das richtige Verhalten von enormer Bedeutung, um Risiken zu minimieren. Durch regelmäßige Schulungen, klare Verfahrensanweisungen und dem konsequenten Streben nach Verbesserungen kann dauerhaft eine qualitativ hochwertige Produktion sichergestellt werden.