Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Feil U.
In der Rubrik Zeitschriften haben wir 2 Beiträge für Sie gefunden
-
Lebenszyklus-Risikoanalyse in der Qualifizierung
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 114 (2017))
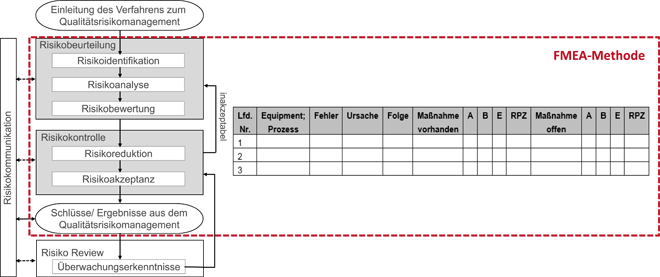
Lebenszyklus-Risikoanalyse in der Qualifizierung / Implementierung eines software-unterstützten Life-Cycle-Risikomanagement-Prozesses – Teil 2 * Teil 1 dieses Beitrags ist erschienen in TechnoPharm 7, Nr. 1, (24–30) (2017). · Gübitz B, Feil U · VTU Engineering GmbH, Raaba-Grambach (Österreich) und Biotest AG, Dreieich
Im ersten Teil dieses Beitrags wurden die Anforderungen an ein GMP-konformes Risikomanagement sowie die ersten Schritte eines Life-Cycle-Risikomanagements für die Qualifizierung beschrieben – nämlich die risikobasierte Definition des Qualifizierungsumfangs (Impact Assessment) sowie die Sicherstellung der Traceability zwischen Betreiberanforderung und Ausschreibungsunterlagen im Projekt. Um die Qualifizierungstiefe der im Impact Assessment als GMP- und damit als qualifizierungsrelevant eingestuften Anlagen festzulegen, werden im Projekt rund 40 Risikoanalysen für Prozessanlagen und Prozessnebenanlagen (Aqua Purificata (AP-Wasser), raumlufttechnische Anlagen, etc.) und 30 Risikoanalysen für Laborgeräte durchgeführt. Diese technischen Risikobetrachtungen werden im Projekt nach der Spezifikations- und Ausschreibungsphase (URS, LH) und vor der DQ-Phase erstellt (Abb. 2). Sie ...
-
Lebenszyklus-Risikoanalyse in der Qualifizierung
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 24 (2017))
Lebenszyklus-Risikoanalyse in der Qualifizierung / Implementierung eines software-unterstützten Life-Cycle-Risikomanagement-Prozesses – Teil 1 · Gübitz B, Feil U · VTU Engineering GmbH, Raaba-Grambach (Österreich) und Biotest AG, Dreieich
Risikoanalyse Anhang 15 EU-GMP-Leitfaden Qualifizierung Lebenszyklus Life-Cycle Risikomanagement FMEA VTU Engineering hat im März 2014 den bisher größten Generalplaner-Engineering-Auftrag in der Geschichte des Unternehmens erhalten. Der Kunde, die Biotest AG, zählt in Teilbereichen des Pharmageschäfts – etwa bei polyspezifischen Immunglobulinen und plasmabasierten Gerinnungsfaktorpräparaten – zu den führenden Anbietern und entwickelt, produziert und vertreibt mit rund 1 900 Mitarbeitern weltweit Medikamente zur Behandlung von Blut- und Immunerkrankungen. Die Verantwortlichkeiten im Zuge der Generalplanung der Produktionsanlage für Blutplasmaprodukte ( Abb. 1 ) reichen dabei vom Kernprozess bis zu den Gartenanlagen, dem Blockheizkraftwerk bis zu den Laborgeräten, vom Medientunnel bis zum Wärterhäuschen. Vermessung, Brandschutz, Akustik, Objektplanung, ...