Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Hock S.
In der Rubrik Zeitschriften haben wir 2 Beiträge für Sie gefunden
-
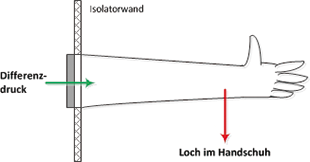
Integritätsprüfung von Isolatorhandschuhen im Sterilbetrieb
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 02, Seite 88 (2016))
Mathe G | Schüller C | Hock S
Integritätsprüfung von Isolatorhandschuhen im Sterilbetrieb / Am Beispiel der Differenzdruckprüfung · Mathe G, Schüller C, Hock S · Boehringer Ingelheim Pharma GmbH & Co. KG
Sterilproduktion Isolator Isolatorhandschuhprüfung Differenzdruckprüfung Evaluierung Ein hohes Risiko für Leckagen in der Isolatorbarriere stellt der Isolatorhandschuh dar. Daher schreiben Good Manufacturing-Practice (GMP)-Leitfäden für die Sterilproduktion wiederkehrende Integritätsprüfungen und Monitorings vor. Um die Systemgrenzen des eingesetzten Prüfsystems, mögliche Einflussfaktoren und die richtigen Prüfparameter für den eingesetzten Handschuhtyp zu finden, geht man streng systematisch vor und bedient sich einfacher Werkzeuge. Trotz der heutigen fortgeschrittenen Automatisierung sind Handschuhe am Isolator nicht aus der Sterilherstellung wegzudenken. Zum Beispiel sind im Inneren des Isolators komplexe Rüstvorgänge und Inprozesskontrollen zu tätigen sowie routinemäßig stattfindende mikrobiologische Bemusterungen durchzuführen und Oberflächen zu bemustern. Auch müssen eventuelle Störungen im Isolator ...
-
Gesetzliche Regelungen zu elektronischen Unterschriften bei der Einreichung von Zulassungsunterlagen für Arzneimittel / Vergleich zwischen der FDA-Richtlinie 21 CFR Part 11 und der EU-Gesetzgebung
Rubrik: -
(Treffer aus pharmind, Nr. 05, Seite 476 (2003))
Gesetzliche Regelungen zu elektronischen Unterschriften bei der Einreichung von Zulassungsunterlagen für Arzneimittel / Vergleich zwischen der FDA-Richtlinie 21 CFR Part 11 und der EU-Gesetzgebung / Hock S
Gesetzliche Regelungen zu elektronischen Unterschriften bei der Einreichung von Zulassungsunterlagen für Arzneimittel Vergleich zwischen der FDA-Richtlinie 21 CFR Part 11 und der EU-Gesetzgebung Dr. Stefan Hock und Till Jostes CSC Ploenzke AG, Wiesbaden Weltweit verlangen Aufsichtsbehörden für die Erteilung bzw. Aufrechterhaltung von Arzneimittelzulassungen große Mengen an Informationen von den antragstellenden Pharmaunternehmen. Beide Seiten haben mittlerweile umfangreiche IT-Investitionen in diesem Bereich vorgenommen. Das Internet spielt bei der Datenübermittlung eine immer wichtigere Schlüsselfunktion. Für einen verläßlichen und sicheren Austausch von Informationen auf diesem Weg ist die elektronische Unterschrift ein entscheidender Bestandteil, der für diese Zwecke jedoch - neben den auf diesem Gebiet üblichen - weiteren rechtlichen Anforderungen, wie z. B. den Good Manufacturing Practices (GMP) oder den Bestimmungen gemäß 21 CFR Part 11, genügen muß. Grundsätzlich sind nach 21 CFR Part 11 geschlossene und offene Systeme zu unterscheiden, eine Einteilung, die in der EU-Gesetzgebung keine Entsprechung findet. Dies hat unterschiedliche Auswirkungen auf die vorgeschriebenen Kontrollanforderungen und Vorgehensweisen. Im Zuge der europäischen Gesetzgebung haben die EU-Mitgliedstaaten inzwischen zahlreiche Gesetze und Vorschriften zur elektronischen Unterschrift verabschiedet, wobei sich die Mehrzahl dieser Bestimmungen jedoch im Gegensatz zu 21 CFR Part 11 nicht direkt auf die Pharmaindustrie, sondern auf allgemeine Anforderungen des elektronischen Geschäftsverkehrs bezieht. Zusammenfassend läßt sich sagen, daß es unterschiedliche rechtliche Ansätze zwischen den USA und der EU - sowie innerhalb der EU-Mitgliedstaaten - gibt. Es empfiehlt sich daher, anhand „formeller Anforderungen“ an die Unterschrift die betroffenen Geschäftsprozesse zu analysieren und anschließend die rechtlichen Rahmenbedingungen sowie die technische Umsetzung zu planen und die konkreten Anforderungen erst bei der Durchführung zu berücksichtigen. Key words 21 CFR Part 11 · Compliance · Elektronische Signatur · Elektronische Unterschrift · Europäische Regelung · Geschlossene Systeme · GMP · Offene Systeme · Public Key-Infrastruktur, PKI-Struktur · Trust Center © ECV- Editio Cantor Verlag (Germany) 2003