Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Bericht aus Europa 01/2011
Rubrik: Ausland
(Treffer aus pharmind, Nr. 01, Seite 114 (2011))
Bericht aus Europa 01/2011 / Blasius H
-
Prozessoptimierung durch Prozessverlinkung
Rubrik: Verfahrenstechnik
(Treffer aus TechnoPharm, Nr. 01, Seite 54 (2011))
Prozessoptimierung durch Prozessverlinkung / Eules • Optimierte Pulverhandlingprozesse und Prozesslinking · Eules T · Dec Deutschland GmbH, Ingolstadt
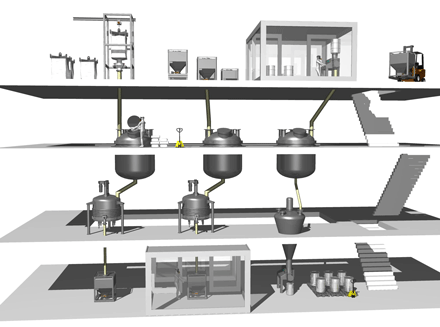
In den allermeisten Fällen werden die Pulver mittels Schwerkraft aus verschiedenen Großgebinden bzw. Schüttgutbehältern entleert. Diese Art der Entleerung erfordert ein Anlagenkonzept in Falllinie, oft über mehrere Stockwerke ( Abb. 1 ). Beim Eintrag in Reaktoren, die brennbare Lösemittel enthalten, entsteht je nach Konzentration ein Gemisch aus Luft und brennbaren Stoffen. Aufgrund von elektrostatischer Aufladung besteht die Gefahr einer Entzündung dieses hybriden Gemisches während der Pulverübertragung [ 1 ]. In diesem Fall ist eine aufwendige Stickstoffspülung erforderlich. Wie können Prozesse miteinander verlinkt werden, um das Containment und somit die Betriebssicherheit zu erhöhen, die Effizienz zu steigern, und Energie zu sparen? Die ...
-
Bericht aus den USA 01/2011
Rubrik: Ausland
(Treffer aus pharmind, Nr. 01, Seite 121 (2011))
Bericht aus den USA 01/2011 / Ruppelt U
-
Patentspiegel 01/2011
Rubrik: Patentspiegel
(Treffer aus pharmind, Nr. 01, Seite 128 (2011))
Patentspiegel 01/2011 / Cremer K
-
100 %-Inline-Qualitätskontrolle mit X-Ray-Technologie
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 01, Seite 60 (2011))
100 %-Inline-Qualitätskontrolle mit X-Ray-Technologie / Entwicklung einer 100 %-Inline-Gewichtskontrolle mit PAT-Elementen für pharmazeutische Kapseln · Vogt M, Beck M, Maga I · Robert Bosch GmbH, Waiblingen
Nach aktuellem Stand der Technik arbeiten Kapselfüllmaschinen („GKF“) mit Produktionsgeschwindigkeiten von 140 Takten pro Minute oder mehr. Dem gegenüber steht der Wunsch eines jeden pharmazeutischen Unternehmers, das Gewicht jeder einzelnen Kapsel genau zu kennen, bevor sie verpackt wird, das Werk verlässt und schließlich vom Endverbraucher konsumiert wird. Zu diesem Zweck wird der Produktionsmaschine in der Regel eine Kapselkontrolleinheit nachgeschaltet, die die befüllten und verschlossenen Kapseln zu 100 % verwiegt. Wirklich „Inline“ ist das allerdings nicht, denn die Kapseln müssen zunächst eine bestimmte Distanz von der Kapselfüllmaschine bis zur Kontrolleinheit überwinden. Die Zuordnung der Kapselgewichte zum Füllprozess in der Kapselfüllmaschine ist dabei ...
-
Neue Trends und Aspekte im Bereich fester Arzneiformen / Bericht über ein Symposium der Wiewelhove GmbH in Osnabrück am 25. November 2010
Rubrik: GMP-Expertenforum
(Treffer aus pharmind, Nr. 01, Seite 134 (2011))
Neue Trends und Aspekte im Bereich fester Arzneiformen / Bericht über ein Symposium der Wiewelhove GmbH in Osnabrück am 25. November 2010 / Podpetschnig-Fopp E
Neue Trends und Aspekte im Bereich fester Arzneiformen Bericht über ein Symposium der Wiewelhove GmbH in Osnabrück am 25. November 2010 Dr. Elke Podpetschnig-Fopp Wiewelhove GmbH, Ibbenbüren Unter der Moderation von Dr. Peter Döbber, Geschäftsführer der Firmen Wiewelhove und DS-Pharma, referierten international anerkannten Experten zu Beginn des Symposiums über innovative und aktuelle Entwicklungen im Bereich fester Arzneiformen. Neben speziellen zulassungsrelevanten Themen, wie der Durchführung von Genotoxizitätsprüfungen bei pflanzlichen Zubereitungen, wurden von verschiedenen Referenten im weiteren Verlauf dann besondere galenische, technologische und analytische Fragestellungen behandelt. © ECV- Editio Cantor Verlag (Germany) 2011
-
Current Aspects and Trends for Parenterals / Report on the PDA Conference “PARENTERALS 2010 / Integrating the Future” held in Berlin (Germany) on 26 trough 28 October 2010
Rubrik: Tagungsberichte
(Treffer aus pharmind, Nr. 01, Seite 137 (2011))
Current Aspects and Trends for Parenterals / Report on the PDA Conference “PARENTERALS 2010 / Integrating the Future” held in Berlin (Germany) on 26 trough 28 October 2010 / Eck V
-
Verfahrensentwicklung eines Granulationsprozesses mit dem Rezepturbestandteil Phosphatidylcholin-Maltodextrin-Komplex
Rubrik: Campus kompakt
(Treffer aus TechnoPharm, Nr. 01, Seite 68 (2011))
Reinbold J | Gumpinger B | Weber E | Kleiner M | Müller I
Verfahrensentwicklung eines Granulationsprozesses mit dem Rezepturbestandteil Phosphatidylcholin-Maltodextrin-Komplex / Reinbold et. al. • Verfahrensentwicklung eines Granulationsprozesses · Reinbold J, Gumpinger B, Weber E, Kleiner M, Müller I · Hochschule Albstadt-Sigmaringen, Sigmaringen und
Die Pharmazie muss sich auf ihrem Weg zu einer modernen Biowissenschaft ständig alt bekannten und neuen Herausforderungen stellen [ 1 ]. Die Verbesserung der Verträglichkeit sowie die Steigerung der Aufnahme der Arzneistoffe im menschlichen Körper sind wichtige Ziele der Arzneimittelentwicklung und -optimierung. Das Beimengen von P hosphatidylcholin-Maltodextrin in den Rezepturen von festen Darreichungsformen könnte – neben weiteren therapeutischen Aspekten von Phospholipiden – eine Möglichkeit sein, dies zu erreichen [ 2 ]. Durch die lipophilen Eigenschaften dieses Hilfsstoffes kann es aber auch Probleme bei der Herstellung solcher Arzneiformen geben. Ziel dieser Bachelorthesis war es, herauszufinden ob es möglich ist, den Hilfsstoff ...
-
16. GMP-Konferenz: Risikomanagement, Sterilfertigung, Compliance
Rubrik: Tagungsberichte
(Treffer aus pharmind, Nr. 01, Seite 144 (2011))
16. GMP-Konferenz: Risikomanagement, Sterilfertigung, Compliance / Schnettler R
16. GMP-Konferenz: Risikomanagement, Sterilfertigung, Compliance Good Distribution Practice (GDP) / Neuerungen in den GMP-Regularien / GMP-Aspekte von Pharmawasser / Risikomanagementsysteme / Fälschung von Arzneimitteln / Annex 1 / Kosten senken durch Compliance Bericht von einer Konferenz der Hochschule Albstadt-Sigmaringen mit der DGGF (Deutsche Gesellschaft für Gute Forschungspraxis) und PTS Training Service am 22./23. November 2010 in München Reinhard Schnettler1, Prof. Dr. Ingrid Müller2 und Cornelia Wawretschek1 PTS Training Service1, Arnsberg, und Hochschule Albstadt-Sigmaringen2 Mit der Implementierung der ICH-Leitlinie Q 10 „Pharmazeutisches Qualitätssystem“ in den EU-GMP-Leitfaden wird Qualitätsrisikomanagement zukünftig zu den Anforderungen gehören. Bislang war das in Anhang 20 beschriebene Qualitätsrisikomanagement lediglich optional anzuwenden, mit der Absicht, dem Hersteller eine Anzahl international anerkannte Risikomanagement-Methoden und -Werkzeuge zur Verfügung zu stellen. Bedingt durch seine vielfältigen Anwendungsmöglichkeiten entwickelt sich Qualitätsrisikomanagement zu einem integralen Bestandteil eines Qualitätsmanagementsystems. Die Änderungen des Anhangs 1 stellen eine neue Epoche der Sterilfertigung dar, da sie mit Betonung des Qualitätsrisikomanagements die Eigenverantwortung der handelnden Personen stärken, ohne deren Handlungsspielraum durch detaillierte Vorgaben einzuschränken. Arzneimittelfälschungen haben weltweit dramatisch zugenommen. In Europa steigt die Zahl der konfiszierten Arzneimittelfälschungen drastisch an. Die Europäische Union (EU) reagiert darauf und bereitet eine Arzneimittelfälschungsrichtlinie vor. Ergänzt wurde die Veranstaltung durch Diskussionsforen und Round Tables. © ECV- Editio Cantor Verlag (Germany) 2011
-
Transfer of Analytical Procedures
Rubrik: Originale
(Treffer aus pharmind, Nr. 01, Seite 152 (2011))
Transfer of Analytical Procedures / Böttcher F
Transfer of Analytical Procedures Frank Böttcher and Timo Krebsbach Labor L+S AG, Bad Bocklet-Großenbrach, Germany Correspondence: Dr. Frank Böttcher, Labor L+S AG, Mangelsfeld 4, 97708 Bad Bocklet-Großenbrach, Germany, e-mail: frank.boettcher@labor-ls.de Transfer analytischer Verfahren Die Pharmaindustrie vergibt zunehmend freigaberelevante Analysen von Arzneimitteln an spezialisierte Laboratorien. Um den Standard der Qualitätskontrolle für die betroffenen Produkte hierbei aufrecht zu erhalten, ist ein analytischer Methodentransfer unbedingt erforderlich. Werden validierte Methoden zwischen Laboren transferiert, so muss der Validierungsstatus der Methoden erhalten bleiben, um zuverlässige Ergebnisse auch im neuen Labor erzielen zu können. Der Transfer analytischer Methoden kann auf verschiedenen Wegen erfolgen, abhängig vom Know-how der betroffenen Labore und abhängig von der Art der Testmethode. Aktuell gibt es keine klaren Vorschriften für den Transfer analytischer Verfahren, z. B. in Form einer offiziellen Guideline. Im vorliegenden Beitrag sind die generellen Aspekte des Transfers analytischer Methoden sowie auch einige praktische Beispiele für den Transfer von chemisch-physikalischen und mikrobiologischen Untersuchungen beschrieben. Key words Contract analysis • Contract laboratory • Know-how transfer • Method transfer • Outsourcing © ECV- Editio Cantor Verlag (Germany) 2011
Sie sehen Artikel 4201 bis 4210 von insgesamt 11884
- Erste Seite
- 419
- 420
- 421
- 422
- 423
- Letzte Seite