Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Druckluftqualität in der Pharmaproduktion
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 40 (2021))
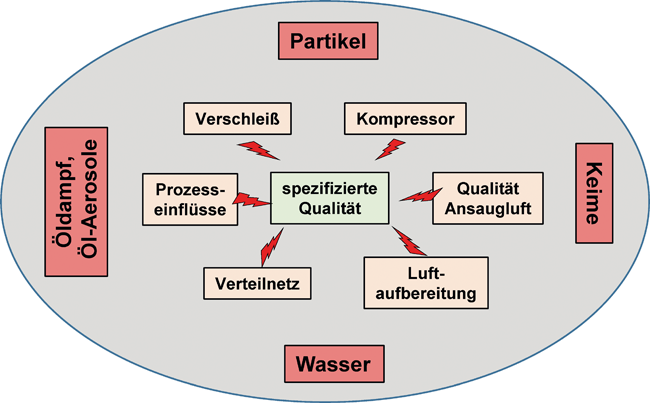
Druckluftqualität in der Pharmaproduktion / Herausforderungen zwischen Compliance und Wirtschaftlichkeit · Rudloff W · gmp-experts GmbH, Neustadt/Weinstraße
Druckluft Contamination Control Strategy (CCS) Spezifikation von Druckluft Kontaminationsrisiken Qualifizierung von Druckluftsystemen Messtechnik Druckluft ist ein wertvolles Medium – nicht nur, wenn man sich die Kosten für die zuverlässige Nutzung von Energie für den zuverlässigen Betrieb eines Druckluftnetzes ansieht. Wertvoll und dementsprechend wichtig ist Druckluft auch deshalb, weil sie dem pharmazeutischen Produkt oft viel näher kommt als angenommen. Druckluft kann bei direktem Kontakt einen weitreichenden Einfluss auf das Produkt haben und erfordert daher eine sehr hohe Aufmerksamkeit im Good-Manufacturing-Practice(GMP)-System. Darüber hinaus wird im aktuellen Entwurf des neuen Annex 1 des EU-GMP-Leitfadens dem Aspekt der C ontamination C ontrol S trategy (CCS) ...
-
Aktivitäten des COMP
Rubrik: europharm
(Treffer aus pharmind, Nr. 01, Seite 105 (2021))
Aktivitäten des COMP / Throm • COMP · Throm S · Geschäftsführer Forschung, Entwicklung, Innovation vfa – Die forschenden Pharma-Unternehmen, Berlin
Vom 1.–3.12.2020 fand bei der Europäischen Arzneimittel-Agentur (EMA) in Amsterdam die 228. Sitzung des Ausschusses für Arzneimittel gegen seltene Krankheiten (Committee for Orphan Medicinal Products, COMP) statt. Dabei verabschiedete der Ausschuss: 12 Empfehlungen für die Zuerkennung des Orphan-Status für die folgenden in Entwicklung befindlichen Medikamente: Calcium oxybat, Magnesium oxybat, Kalium oxybat, Natrium oxybat zur Behandlung der idiopathischen Hypersomnie; Jazz Pharmaceuticals rekombinantes humanes Laminin-111 zur Behandlung der ererbten Muskeldystrophie; Maxia Strategies Rilonacept zur Behandlung der idiopathischen Pericarditis; Granzer Regulatory Consulting & Services Setanaxib zur Behandlung der primären biliären Cholangitis; GenKyoTex Alpha Galactosidase A zur Behandlung von Morbus Fabry; Consejo Superior De Investigaciones Cientificas Celecoxib, ...
-
Aktivitäten des PDCO
Rubrik: europharm
(Treffer aus pharmind, Nr. 01, Seite 107 (2021))
Aktivitäten des PDCO / Throm • PDCO · Throm S · Geschäftsführer Forschung, Entwicklung, Innovation, vfa – Die forschenden Pharma-Unternehmen, Berlin
Bei der virtuellen Sitzung vom 10.–13.11.2020 verabschiedete der Ausschuss für Kinderarzneimittel (PDCO): 9 positive Voten zu pädiatrischen Prüfkonzepten (PIP) für folgende in Entwicklung befindliche Medikamente: Olinciguat zur Behandlung der Sichelzellkrankheit; Cyclerion Therapeutics Tabelecleucel zur Behandlung von Epstein-Barr-Virus-assoziierten lymphproliferativen Störungen nach einer Transplantation; Atara Biotherapeutics Venglustat zur Behandlung der autosomalen dominanten polyzystischen Nierenkrankheit; Genzyme Europe voll humanisierter IgG1-RB-1 YTE-monoklonaler Antikörper gegen RSV F (MK-1654) zur Prävention von Infektionen des unteren Atemtrakts durch das respiratorische Syncytial-Virus (RSV); MSD Voxelotor zur Behandlung der Sichelzellkrankheit; Synteract Etrasimod L-Arginin zur Behandlung der Colitis ulcerosa; Arena Pharmaceuticals (R)-2-(1-(6-Amino-5-chlorpyrimidin-4- carboxamido)ethyl)-N-(5-chlor-4-(trifluormethyl)pyridin-2-yl)thiazol-5-carboxamid zur Behandlung von pädiatrischen niedriggradigen Gliomen; DOT ...
-
Aktivitäten des PRAC
Rubrik: europharm
(Treffer aus pharmind, Nr. 01, Seite 108 (2021))
Aktivitäten des PRAC / Aktuelle Empfehlungen des Ausschusses für Risikobewertung im Bereich der Pharmakovigilanz der Europäischen Arzneimittel-Agentur (EMA) · Thurisch B, Sickmüller B · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee, PRAC) ist in erster Linie für die Beurteilung aller Aspekte des Risikomanagements von Humanarzneimitteln zuständig. Dies umfasst die Ermittlung, Bewertung, Minimierung und Kommunikation der Risiken von Nebenwirkungen, unter gebührender Berücksichtigung des therapeutischen Nutzens des Humanarzneimittels, der Gestaltung und Bewertung der Unbedenklichkeitsstudien nach der Genehmigung sowie Pharmakovigilanz-Audits. Der PRAC gibt somit – abhängig vom jeweiligen Verfahren – Empfehlungen an den Ausschuss für Humanarzneimittel (Committee for Medicinal Products for Human Use, CHMP), die Koordinierungsgruppe (Co-ordination Group for Mutual Recognition and Decentralised Procedures, CMDh), die Europäische Arzneimittel-Agentur (EMA) oder die Europäische ...
-
Austauschbarkeit biologischer Arzneimittel
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 01, Seite 112 (2021))
Austauschbarkeit biologischer Arzneimittel / Krüger und Runge • Austauschbarkeit biologischer Arzneimittel · Krüger C, Runge M · Sander & Krüger Rechtsanwälte PartG mbB, Frankfurt am Main
Der Gesetzgeber hat mit den Regelungen in § 129 SGB V die rechtlichen Grundlagen für den Austausch von Generika sowie mit neuen Bestimmungen durch das am 15.08.2019 in Kraft getretene Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) für Biosimilars gelegt. Dieser Aufsatz untersucht die rechtlichen Rahmenbedingungen, den Stand der geplanten Regelungen für Biosimilars und die Situation im Hinblick auf biologische Arzneimittel.
-
Entscheidungsregeln zur Konformitätsbewertung in Kalibrierscheinen
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 01, Seite 46 (2021))
Entscheidungsregeln zur Konformitätsbewertung in Kalibrierscheinen / Sander • Konformitätsbewertung in Kalibrierscheinen · Sander C · Testo Industrial Services, Kirchzarten
Konformitätsbewertung bei Kalibrierungen Entscheidungsregeln gemäß DIN EN ISO/IEC 17025:2018 Wahl des Vertrauensniveaus Risiko von Falschaussagen Akzeptanzbereiche & Toleranzgrenzen Die Hersteller von Arzneimitteln und Medizinprodukten sind für die Einhaltung der festgelegten Anforderungen an ihre Produktqualität verantwortlich. Um die Qualitätsmerkmale von Produktionschargen zuverlässig ermitteln zu können, ist eine präzise Steuerung der Prozesse (inkl. Monitoring) essenziell. Im Rahmen der Qualitätskontrolle sind zudem Bemusterungen und Messungen notwendig. Die regelmäßige Kalibrierung der Messstellen und der eingesetzten Prüfmittel ist dafür ein wichtiges qualitätsinduzierendes Instrument, welches in folgenden regulatorischen Dokumenten beschrieben wird: EU-GMP-Leitfaden Teil I (Kapitel 3.41) „Die Mess-, Wäge-, Aufzeichnungs- und Kontrollausrüstung sollte kalibriert sein und in ...
-
Essentials aus dem Pharma- und Sozialrecht
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 01, Seite 119 (2021))
Essentials aus dem Pharma- und Sozialrecht / Arzneimittelversorgung nach dem VOASG – was ist neu? · Rybak C, Eppingen S · Ehlers, Ehlers & Partner Rechtsanwaltsgesellschaft mbB, München
Für gesetzlich Versicherte sollen künftig bei verschreibungspflichtigen Arzneimitteln die gleichen Preise gelten – unabhängig davon, ob sie über eine Apotheke vor Ort oder eine Versandapotheke aus einem anderen EU-Mitgliedsstaat bezogen wurden. Beabsichtigt ist, dass Versandapotheken aus anderen EU-Mitgliedsstaaten gesetzlich Versicherten keine Rabatte mehr gewähren dürfen. Daraus ergeben sich insbesondere Änderungen in § 129 Fünftes Buch Sozialgesetzbuch (SGB V), im Apothekengesetz und des Gesetzes über Rabatte für Arzneimittel. Die Kompetenzen der Apotheker werden zudem erweitert: Apotheken sollen u. a. sog. pharmazeutische Dienstleistungen anbieten und dafür auch eine Vergütung erhalten. Mit Einführung des § 31 Abs. 1b SGB V ist nun die Ausstellung eines Wiederholungsrezepts möglich. Weitere Änderungen ...
-
Analytisches Zentrum Biopharm, Berlin – Zeit für Neues.Basis- und High-End-Methoden für praxisorientierte Lösungen.
Rubrik: Unternehmensprofile
(Treffer aus pharmind, Nr. 01, Seite 123 (2021))
Analytisches Zentrum Biopharm, Berlin – Zeit für Neues.Basis- und High-End-Methoden für praxisorientierte Lösungen. / pharmind • Unternehmensprofile
AZ Biopharm ist seit 25 Jahren als mittelständisches, unabhängiges Analytiklabor mit breitem Methodenspektrum am Standort Berlin tätig ( Abb. 1 ). Analytik und Bioanalytik unter GMP und GLP gehören zu den Kernkompetenzen. Schnelle Antworten auf aktuelle Fragestellungen sind Standard. Die EU-Überwachungsbehörden fordern im Oktober 2020 Nitrosamin-Untersuchungen von metforminhaltigen Arzneimitteln: „Die europäische Arzneimittelbehörde EMA und die zuständigen nationalen Behörden in der EU werden alle Zulassungsinhaber metforminhaltiger Arzneimittel kontaktieren und diese auffordern, alle metforminhaltigen Fertigarzneimittel vor ihrer Marktfreigabe auf das Vorhandensein von Nitrosaminen zu testen.“ 1) Das Analytische Zentrum Biopharm verfügt über eine GC-MS-Methode mit einer Empfindlichkeit, die es erlaubt, Nitrosamine (NMDA) in ... -
Aufbau eines Reinraumlüftungssystems
Rubrik: GMP-Aspekte in der Praxis
(Treffer aus pharmind, Nr. 01, Seite 126 (2021))
Aufbau eines Reinraumlüftungssystems / Flechl • Reinraumlüftungssystem · Flechl H · Reinraum – Klima – Kälte, Wien (Österreich)
Die atmosphärische Luft ist mit verschiedenen Stoffen unterschiedlicher Teilchengröße und unterschiedlicher Art durchsetzt. Dieses Gemisch an Inhaltsstoffen gilt es durch geeignete Luftfilter soweit zu reinigen, dass die geforderten Reinheitsbedingungen in einer Produktionsstätte eingehalten werden.
-
Requalifizierung eines Reinraumbekleidungssystems
Rubrik: Originale
(Treffer aus pharmind, Nr. 01, Seite 132 (2021))
Moschner C | Stärk A | Nagel H | Gaza S
Requalifizierung eines Reinraumbekleidungssystems / Unter Berücksichtigung der typischen Alterungserscheinungen · Moschner C1, Stärk A2, Nagel H2, Gaza S1 · 1Dastex Reinraumzubehör GmbH & Co. KG, Muggensturm und 2Novartis Pharma Stein AG, Stein (Switzerland)
Requalifizierung Reinraumbekleidung cleanroom garments Annex 1 Kontaminationskontrolle Wie oft ist eine Reinraumkleidung einsetzbar? Eine Frage, die immer häufiger in Audits gestellt wird und in vielen Fällen nicht unbedingt gleich beantwortet werden kann. Hintergrund dieser Frage ist die leicht nachzuvollziehende Erkenntnis, dass die Performance einer waschbaren Reinraumbekleidung mit der zunehmenden Anzahl an Dekontaminations- (= Waschen und Trocknen) und anschließenden Sterilisations- sowie Tragezyklen durch alterungsbedingte Effekte über die Zeit abnimmt. Dies gilt umso mehr, wenn die Bekleidung noch zusätzlich sterilisiert wird. Auch die im Entwurf (2020) zum neuen Annex 1 des EU-GMP-Leitfadens [ 1 ] geforderte Kontaminationskontrollstrategie verlangt, dass alle Parameter, die ...
Sie sehen Artikel 9581 bis 9590 von insgesamt 11884
- Erste Seite
- 957
- 958
- 959
- 960
- 961
- Letzte Seite