PRAC – News | Beitrag aus pharmind 88 | Nr. 2 | Seite XXXII-XXXIV (2026)
12.03.2026Der Ausschuss für Risikobewertung im Bereich Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee, PRAC) ist ein wissenschaftliches Gremium der Europäischen Arzneimittel-Agentur (European ...
Sicherheit durch ganzheitliche Lösungen schaffen
12.03.2026Bausch+Ströbel rückt zur Interpack 2026 eine klare Botschaft in den Vordergrund: Sicherheit entsteht nicht allein durch Technik, sondern durch ein tiefes Verständnis der pharma-zeutischen ...
Klinische Forschung stärken: Standardvertragsklauseln und weitere Schritte für einen wettbewerbsfähigen Studienstandort
12.03.2026„Vertragsverhandlungen für Klinische Prüfungen: Wie helfen Verordnung & Co?“ war Titel und Fragestellung eines Symposiums am 10. März in Berlin, für das Vertreterinnen und Vertreter aus ...
Gesundheitssystem: Auf Krieg und Krisen nicht gut vorbereitet
12.03.2026Ist das Gesundheitswesen und die Arzneimittelversorgung auf Krisensituationen vorbereitet? Der Pharmaverband BPI hat darauf eine klare Antwort: Sie lautet Nein – und hat eine Sicherheitsstrategie ...
Europa muss klinische Studien einfacher machen
12.03.2026Der Verband der forschenden Pharma-Unternehmen (vfa) hat heute auf Einladung des Bundesministeriums für Gesundheit zum geplanten European Biotech Act I Stellung genommen. Das Gesetzespaket der EU ...
BioNTech und Mitgründer kündigen Pläne für neues Mitgründer-geführtes Unternehmen zur Entwicklung von mRNA-Innovationen der nächsten Generation an
11.03.2026BioNTech SE gab Pläne für ein eigenständiges neues Unternehmen bekannt, das von den BioNTech-Mitgründern Prof. Dr. Ugur Sahin und Prof. Dr. Özlem Türeci gegründet und geleitet werden soll. Das ...
Arzneimittelkosten bleiben auch 2025 im Rahmen: Pharma Deutschland widerspricht Kassen-Alarmismus
12.03.2026Die vom Bundesgesundheitsministerium vorgestellten GKV-Finanzergebnisse zeigen: Zwar steigen die Ausgaben der gesetzlichen Krankenkassen deutlich, doch der Anteil der Arzneimittelausgaben an den ...
Evotec kündigt „Horizon“ an – nächster Wendepunkt in der strategischen Transformation zur Beschleunigung des Wachstums und Förderung der Agilität
12.03.2026Evotec SE kündigte „Horizon“ an, die nächste Phase ihrer mehrstufigen Transformationsinitiative. Horizon treibt die Weiterentwicklung des Unternehmens durch die Implementierung eines neuen, ...
Merck: Prognose für 2025 veröffentlicht, Wachstumsgrundlage geschaffen
12.03.2026Merck, ein führendes Wissenschafts- und Technologieunternehmen, hat seine Prognose für 2025 erfüllt und trotz erheblicher Herausforderungen organisches Wachstum erzielt. Wesentliche ...
IMCD ernennt Hedwig Koopmans zur Geschäftsführerin für die Schweiz
12.03.2026Die IMCD Group, ein weltweit führender Partner für den Vertrieb und die Formulierung von Spezialchemikalien und Inhaltsstoffen, hat Hedwig Koopmans mit Wirkung zum 1. April 2026 zur ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
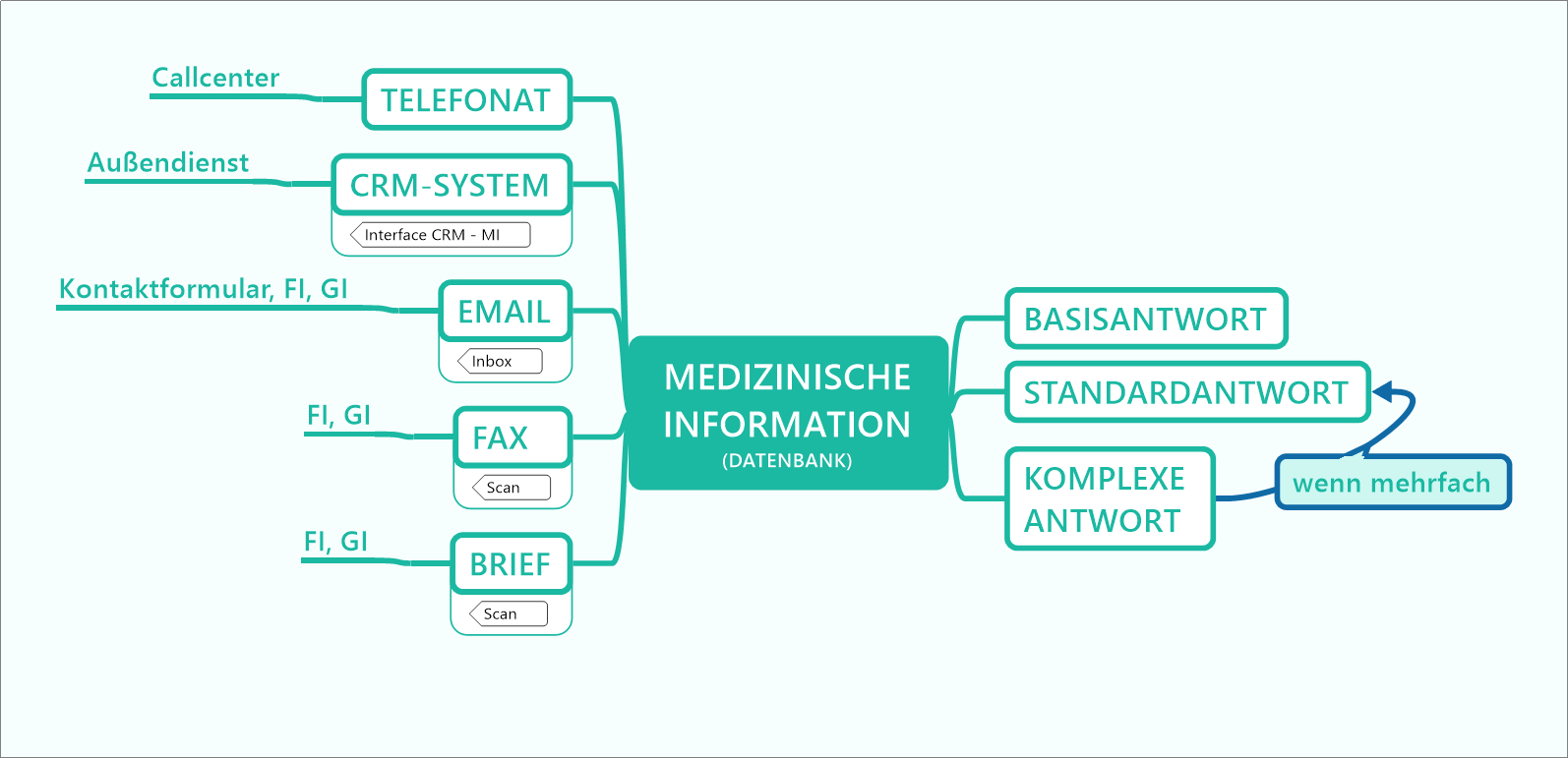
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.