Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-

VisoTec: Perfekt dosiert – flexibel und punktgenau
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 242 (2018))
VisoTec: Perfekt dosiert – flexibel und punktgenau / Sonderteil ACHEMA 2018
Mit diesem Motto hat sich das bayerische Unternehmen ViscoTec Pumpen- und Dosiertechnik GmbH *) auf der Achema präsentiert. Im Mittelpunkt standen dabei die Dosiersysteme für hochviskose Medien. Durch das flexible Baukastensystem werden Anwendungen in den verschiedensten Industrien von Chemie bis hin zu Pharma ermöglicht. Die Ausstellungsobjekte am Stand haben den Kunden die Stärken der Exzenterschneckenpumpen aufgeführt. Mit der VPHD Baureihe für die Pharmaindustrie deckt der Dosiertechnikhersteller einen breiten Viskositätsbereich ab. Speziell mit dem neuen 4VPHD6 sind Kleinmengendosierungen ab 0,1 ml oder pulsationsfreie, kontinuierliche Dosierungen ab 0,18 ml realisierbar. -

Stöcklin Logistik AG
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 242 (2018))
Stöcklin Logistik AG / Sonderteil ACHEMA 2018
Die Stapler von Stöcklin Logistik *) sind bekannt für beste Qualität, lange Lebensdauer und höchste Wartungsfreundlichkeit. Ob INOX-Stapler in Edelstahl-Ausführung für den Hygieneschutz, Geräte für den explosionsgeschützten Bereich oder speziell auf Ihre Bedürfnisse zugeschnittene individuelle Anfertigungen – Wir bauen alles, was die Physik erlaubt . Stöcklin ist ein europäischer OEM-Hersteller. Konzentrierte man sich bisher auf eine neue, explosionsgeschützte Baureihe aus Deichsel-Nieder- und Hochhubwagen, stehen jetzt auch Sonderbauformen wie Fasskipper oder Klammergeräte im Fokus. Absolute Weltneuheit ist die erste Lithium-Ex-Zone-1-fähige Staplerbatterie, zugelassen für Gas und Staub. -
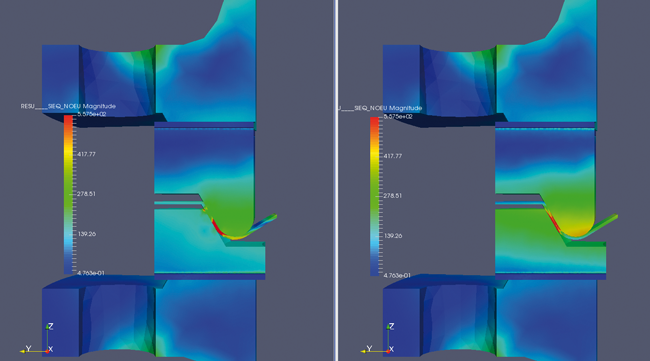
REMBE
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 242 (2018))
REMBE / Sonderteil ACHEMA 2018
Als relativ junge Disziplin ist Computer Aided Engineering (CAE) seit einiger Zeit auf dem Vormarsch. REMBE *) bietet als erster Berstscheibenhersteller weltweit entsprechende CAE-Leistungen an. Die Vorteile dieser Entwicklungs- und Berechnungsmethoden: Durch die Simulationen und Berechnungen mittels CAE werden Entwicklungsprozesse beschleunigt und Ausgaben für Prototypen reduziert. Im Hinblick auf Anlagenelemente und Druckabsicherungseinrichtungen sind v. a. Festigkeitsnachweise, Dichtigkeits- und Strömungsanalysen sowie Temperaturverläufe relevant. Für Anlagenbetreiber entfällt damit die Einbindung eines Ingenieurbüros oder ähnlicher auf CAE spezialisierter Dienstleister. Zusammen mit den REMBE-Produkten erhalten Kunden so eine Komplettlösung mit echtem Mehrwert: Die CAE-Berechnungen garantieren zuverlässigste Ergebnisse, die in die kundenindividuelle Herstellung der Berstscheiben ... -

AZO
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 240 (2018))
AZO / Sonderteil ACHEMA 2018
Die neu konzipierte Siebmaschine DA Vario Containment von AZO *) bietet die Möglichkeit, die bekannte Inspektionsluke ohne Staubaustritt zu öffnen und so die Siebkontrolle ohne Staubaustritt durchzuführen. Des Weiteren kann ein Siebkorbwechsel sowie der Austausch der Dosierschnecke unter Containment-Bedingungen realisiert werden. Die Besonderheit des Maschinentyps DA ist, dass kein vorgeschaltetes Dosierorgan erforderlich ist. Die Dosierleistung der eingebauten Zuführschnecke kann über Frequenzumrichter auf die produktspezifischen Erfordernisse angepasst werden. Beim Typ DA Vario kann zusätzlich die Leistungsanpassung der Siebmaschine durch Kombination verschiedener Dosierschnecken mit dem Siebmodul erfolgen. -

Perlen Packaging
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 240 (2018))
Perlen Packaging / Sonderteil ACHEMA 2018
Perlen Packaging *) präsentiert den weltweit ersten thermisch geformten Einweg-Inhaler PERLAMED TM - BLISTair. Das Device besteht aus 2 thermisch geformten Folien, welche den aktiven Wirkstoff sicher verschließen. Mittels Perlens Hochbarrierefolie ist das Pulver geschützt, eine Folie, welche seit Jahren bereits durch Perlen vertrieben wird. Das Device zeichnet sich dadurch aus, dass die Primärverpackung gleichzeitig das Device ist. Die Handhabung ist intuitiv, da lediglich die Alu-Lasche gezogen werden muss, vor der Inhalation. Die Herstellung des Devices wurde mit dem Kooperationspartner Uhlmann Pac-Systeme GmbH bewerkstelligt und bezieht sich auf bereits existierende, bekannte und kontrollierbare Thermo-Form-Prozesse. -

LETZNER Pharmawasseraufbereitung
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 240 (2018))
LETZNER Pharmawasseraufbereitung / Sonderteil ACHEMA 2018
Auf der Achema stand bei der Firma Letzner Pharmawasseraufbereitung *) das Thema WFI-Erzeugung im Vordergrund. So wurde neben einer klassischen Destillationsanlage auch die Produktneuheit LetzM-WFI ausgestellt, eine Anlage zur Erzeugung von kaltem WFI mittels Membranverfahren. Beim Design und der Prozessüberwachung dieser Anlage wurde großer Wert auf die genaue Umsetzung der vorläufigen Leitlinie der EMA gelegt. Eine zusätzliche Besonderheit stellt die Verwendung sehr robuster Keramikmembranen mit einem Cut-Off von 5 000 Dalton dar, deren Integrität im laufenden Betrieb überprüft werden kann und die mittels heißem Wasser und Ozon sanitisiert werden können (Patent angemeldet). Darüber hinaus wurde mit LetzO 3 eine weitere Produktneuheit ... -

Stäubli Robotics
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 238 (2018))
Stäubli Robotics / Sonderteil ACHEMA 2018
Stäubli Robotics *) feierte auf der Achema die Premiere der neuen TS2-SCARA-Generation. Die von Grund auf neu konstruierten SCARA-Roboterarme sind jetzt modular aufgebaut und verfügen erstmals über eigenentwickelte Hohlwellenantriebe. Diese patentierte JCS-Antriebstechnik ist der Schlüssel sowohl für den enormen Performancezugewinn der TS2-Vierachser als auch für ein einzigartiges Reinraumdesign, bei dem außenliegende Leitungen endgültig der Vergangenheit angehören. Durch innenliegende Kabel lassen sich Fehlerquellen und Partikelemissionen vermeiden. Ein komplett abgedichtetes Gehäuse, die Pinole oben optional mit einem Deckel geschützt und mit Spezialschrauben verschraubt, die Anschlüsse auf Wunsch unter dem Roboterfuß verborgen – so geht Hygienedesign heute. -

Röltgen
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 238 (2018))
Röltgen / Sonderteil ACHEMA 2018
Auf der Achema 2018 hat Röltgen *) zum ersten Mal die neue Version der Ein-Stempel-Tablettenpresse FlexiTab XL für die Forschung und Entwicklung präsentiert. Die neue FlexiTab XL ist eine komplette Neuentwicklung und viele Wünsche der bisherigen Nutzer flossen mit in die Entwicklung ein. Das Äußere der FlexiTab wurde von einem Designer vollkommen neugestaltet und besteht aus einem geschweißten Grundgestell, das mit polierten Edelstahlblechen verkleidet ist. Es ist funktional, ergonomisch und platzsparend aufgebaut. Im Zuge des neuen Designs wurde auch der Antrieb der Füllschuhe überarbeitet. Dieser liegt nun unter dem geschlossenen Matrizentisch und kommt ohne Pneumatikleitungen aus. Durch die Ansteuerung verfahren die ... -

Testo Industrial Services auf der Achema 2018
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 238 (2018))
Testo Industrial Services auf der Achema 2018 / Sonderteil ACHEMA 2018
Auf der diesjährigen Achema präsentierte sich die Testo Industrial Services GmbH *) als Dienstleister für akkreditierte Kalibrierungen, fachgerechte Qualifizierung & Validierung sowie GxP-Services nach Maß. Am Messestand erweckten insbesondere unsere Dienstleistungen Anlagen-, Lager- und Reinraumqualifizierungen sowie Kalibrierungen großes Interesse. Mit der Akkreditierung als Prüflabor für Reinraum-Dienstleistungen konnten wir unseren Standbesuchern zudem einen neuen Kompetenznachweis der DAkkS präsentieren. Als einer der wenigen Dienstleister in Deutschland sichern wir die hohe Qualität unserer Reinraumdienstleistungen über akkreditierte Messverfahren ab. -

Müller
Rubrik: Sonderteil ACHEMA 2018
(Treffer aus TechnoPharm, Nr. 04, Seite 237 (2018))
Müller / Sonderteil ACHEMA 2018
Auf der Achema stellte Müller *) eine voll automatisierbare Containment-Klappe MCV-LW aus Kunststoff vor. Die gewichts- und kostenoptimierte Bauweise macht die Bedienung der MCV-LW leicht und trägt zur Sicherheit und Flexibilität bei den Arbeitsabläufen bei. Die Bedienelemente für Verriegelung und Klappenbetätigung sind auch in Pneumatikausführung erhältlich. Das Klappenventil MCV-LW ist für eine GMP-gerechte Verarbeitung von Pulver und Granulaten konstruiert. Mit der single-use-tauglichen Ausführung wird das Risiko für Cross-Kontamination reduziert. Der modulare Aufbau erlaubt die Integration von Stellungssensoren und Hubvorrichtungen für automatisiertes An- und Abdocken. Die Klappe wird in verschiedenen Durchmessern erhältlich sein.
Sie sehen Artikel 3751 bis 3760 von insgesamt 11938
- Erste Seite
- 374
- 375
- 376
- 377
- 378
- Letzte Seite




