Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
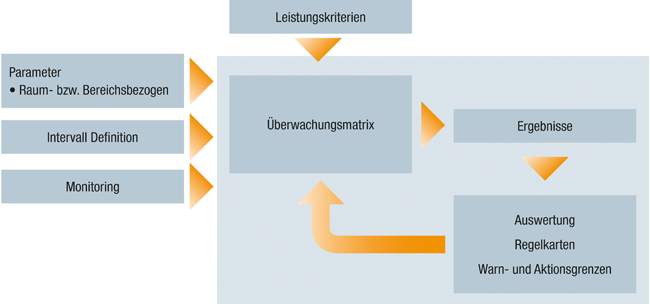
Monitoring von Pharmawasser
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 92 (2019))
Monitoring von Pharmawasser / Brandes und Seyfarth • Pharmawasser · Brandes R, Seyfarth H · Wirtschaftsgenossenschaft deutscher Tierärzte eG (WDT), Garbsen und Mikrobiologe, Biberach
Pharmawasser Monitoring Warnlimit Aktionslimit Probenahme Die Qualität von Pharmawasser wird durch eine Vielzahl von festgelegten Parametern definiert. Um sicherzustellen, dass diese Qualität während des Betriebs der Wasseranlage aufrechterhalten wird, ist ein sog. Monitoring erforderlich. Darunter versteht man eine regelmäßige Durchführung von physikalischen Messungen sowie chemischen und mikrobiologischen Untersuchungen. Das Europäische Arzneibuch nennt hier insbesondere das mikrobiologische Monitoring sowie die Überprüfung von TOC und Leitfähigkeit. Das Monitoringprogramm beinhaltet neben der Überwachung der physikalischen und mikrobiologischen Parameter auch eine regelmäße Beurteilung von Messwerten und Trends. Dies muss durch entsprechend geschultes und qualifiziertes Personal erfolgen. Die Messstellen müssen hinsichtlich ihrer Einbaulage richtig ausgewählt ...
-
Aktivitäten des PRAC
Rubrik: europharm
(Treffer aus pharmind, Nr. 02, Seite 212 (2019))
Aktivitäten des PRAC / Aktuelle Empfehlungen des Ausschusses für Risikobewertung im Bereich der Pharmakovigilanz der Europäischen Arzneimittel-Agentur (EMA) · Thurisch B, Sickmüller B · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee – PRAC) ist in erster Linie für die Beurteilung aller Aspekte des Risikomanagements von Humanarzneimitteln zuständig. Dies umfasst die Ermittlung, Bewertung, Minimierung und Kommunikation der Risiken von Nebenwirkungen, unter gebührender Berücksichtigung des therapeutischen Nutzens des Humanarzneimittels, der Gestaltung und Bewertung der Unbedenklichkeitsstudien nach der Genehmigung sowie Pharmakovigilanz-Audits. Der PRAC gibt somit – abhängig vom jeweiligen Verfahren – Empfehlungen an den Ausschuss für Humanarzneimittel (CHMP 1) ), die Koordinierungsgruppe (CMDh 2) ), die Europäische Arzneimittel-Agentur (EMA) oder die Europäische Kommission ab. Abhängig vom Zulassungstyp (zentral, dezentral, gegenseitige Anerkennung oder ...
-
Aktivitäten des COMP
Rubrik: europharm
(Treffer aus pharmind, Nr. 02, Seite 206 (2019))
Aktivitäten des COMP / Throm • COMP · Throm S · Geschäftsführer Forschung, Entwicklung, Innovation vfa – Die forschenden Pharma-Unternehmen, Berlin
Vom 22.–24. Jan. 2019 fand bei der Europäischen Arzneimittel-Agentur (EMA) in London die 207. Sitzung des Ausschusses für Arzneimittel gegen seltene Krankheiten (Committee for Orphan Medicinal Products, COMP) statt. Dabei verabschiedete der Ausschuss: 12 Empfehlungen für die Zuerkennung des Orphan-Status für die folgenden in Entwicklung befindlichen Medikamente: Autologe adulte lebende kultivierte Osteoblasten zur Behandlung von nicht traumatischen Osteonekrosen; Clinical Network Services (UK) Lurbinectedin zur Behandlung des kleinzelligen Lungenkarzinoms; Pharma Mar 9-cis, 12-cis-11,11-D2-Linolsäureester zur Behandlung der infantilen neuroaxonalen Dystrophie; FGK Representative Service Allogenes kultiviertes postnatales Thymusgewebe zur Behandlung des DiGeorge-Syndroms; Enzyvant Therapeutics Ireland Allogenes kultiviertes postnatales Thymusgewebe zur Behandlung des CHARGE-Syndroms; Enzyvant Therapeutics ...
-
Aktivitäten des PDCO
Rubrik: europharm
(Treffer aus pharmind, Nr. 02, Seite 209 (2019))
Aktivitäten des PDCO / Throm • PDCO · Throm S · Geschäftsführer Forschung, Entwicklung, Innovation, vfa – Die forschenden Pharma-Unternehmen, Berlin
Bei seiner Sitzung vom 11.–14. Dez. 2018 verabschiedete der Ausschuss für Kinderarzneimittel (PDCO): 6 positive Voten zu pädiatrischen Prüfkonzepten (PIP) für folgende in Entwicklung befindliche Medikamente: Filgotinib zur Behandlung von Morbus Crohn und Colitis ulcerosa; Gilead Sciences Rilpivirin zur Behandlung einer HIV-1-Infektion; Janssen-Cilag Ozanimod zur Behandlung von Morbus Crohn; Celgene Etripamil zur Behandlung supraventrikulärer Arrhythmien; Milestone Pharmaceuticals Ianalumab zur Behandlung der autoimmunen Hepatitis; Novartis Vierfach-Influenza-Spaltimpfstoff zur Verhütung einer Influenza-Infektion; Sanofi Pasteur 1 Ablehnung des beantragten PIP für: Turoctocog alfa pegol zur Behandlung der ererbten Hämophilie A; Novo Nordisk 11 Voten für die Freistellung (Waiver) von folgenden Medikamenten: Amantadin Hydrochlorid zur Behandlung von ...
-
Englischsprachige Verträge in der klinischen Forschung
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 02, Seite 214 (2019))
Jungk
Englischsprachige Verträge in der klinischen Forschung / Jungk • Englischsprachige Verträge · Jungk** Of Counsel bei Graf Kanitz S ** Of Counsel bei Graf Kanitz S · Rechtsanwaltskanzlei, Neubiberg
Nahezu alle Verträge, die in der klinischen Forschung geschlossen werden, werden in der englischen Sprache abgefasst. Diese Verträge umfassen 20, 30, manchmal bis zu 50 Seiten, dazu kommen noch umfangreiche Anlagen. Der Inhalt der Klauseln ist für Nicht-Juristen oft schwer verständlich. Im Gegensatz dazu enthalten ähnliche Verträge in deutscher oder einer anderen kontinentaleuropäischen Sprache weniger standardisierte Formulierungen und sind kompakter als ihre englischen Pendants. Woran liegt das?
-
Reinraumtechnik
Rubrik: Buchbesprechungen
(Treffer aus pharmind, Nr. 02, Seite 223 (2019))
Reinraumtechnik / pharmind • Buchbesprechungen
Im Springer Verlag ist das VDI-Buch „Reinraumtechnik“ in der 4. Auflage erschienen. Aufgrund der raschen Fortentwicklung der Reinraumtechnologie und der Regularien ist eine Überarbeitung der 3. Auflage von 2011 angebracht und sehr zu begrüßen. In dem Fachbuch beschreiben auf über 900 Seiten ausgewiesene Experten in eigenständigen Kapiteln die physikalischen Grundlagen und Definitionen in der Reinraumtechnik, die Herstellung von Reinräumen oder geschützten Umgebungen sowie die Automation der Reinraumanlagen, die Ursachen, Vermeidung, Aufrechterhaltung, Beseitigung und Kontrolle von Kontaminationsquellen durch Umgebung, Mensch und Maschinen, den messtechnischen und qualifizierten Nachweis sowie die Dokumentation von Reinraumbedingungen und die Ver- und Entsorgung der Produktionsanlagen mit reinen ... -
Pharmarecht
Rubrik: Buchbesprechungen
(Treffer aus pharmind, Nr. 02, Seite 222 (2019))
Pharmarecht / pharmind • Buchbesprechungen
Ein Lehrbuch zum Pharmarecht auf den Markt zu bringen, stellt eine enorme Herausforderung dar: Die davon erfassten Rechtsgebiete sind zahl- und umfangreich. Dazu gehören zuvörderst das Arzneimittel- und das Medizinprodukterecht, die im Lehrbuch schwerpunktmäßig behandelt werden. Aber auch in diesen beiden Rechtsgebieten mussten die Autoren Schwerpunkte setzen, weil eine vollständige Darstellung dieser Rechtsgebiete den Rahmen eines Lehrbuches sprengte. Im Arzneimittelrecht liegt der Schwerpunkt im Recht der Zulassung (S. 29–145), nach sehr prägnanten Erläuterungen des Arzneimittelbegriffs (S. 21–24) und der Abgrenzung zu anderen Produktkategorien (S. 25–29) wie Lebensmitteln, Kosmetika, Tabakerzeugnissen, Biozid-Produkten, Medizinprodukten und menschlichen Organen. Das Lehrbuch gibt sogar einen Ausblick auf ... -
Essentials aus dem Pharma- und Sozialrecht
Rubrik: Gesetz und Recht
(Treffer aus pharmind, Nr. 02, Seite 220 (2019))
Essentials aus dem Pharma- und Sozialrecht / Rechtliche Anforderungen an ein Verbot des Versandhandels mit Arzneimitteln · Ehlers A, Rybak C, Michel I · Ehlers, Ehlers & Partner, München
Seit längerer Zeit wird ein Versandhandelsverbot für verschreibungspflichtige Arzneimittel diskutiert. Vor allem auf Seiten der Apotheker wird ein entsprechendes Verbot gefordert. Nach andauernder politischer Debatte und der Vereinbarung im Koalitionsvertrag zwischen CDU/CSU und SPD bezüglich eines Verbots des Versandhandels von verschreibungspflichtigen Arzneimitteln, äußerte sich kürzlich Bundesgesundheitsminister Jens Spahn (CDU) am Rande einer Mitgliederversammlung der Bundesvereinigung deutscher Apothekerverbände (ABDA) in Berlin abschließend in dieser Sache. Ein Versandhandelsverbot, so meint er, sei „europarechtlich und vor allem politisch unwägbar“ . 1)
-
Compliance im Reinraum durch Überwachung
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 02, Seite 98 (2019))
Compliance im Reinraum durch Überwachung / Praktische Umsetzung der Forderungen aus DIN EN ISO 14644-2:2016 – Teil 2*Teil 1 dieses Beitrags ist erschienen in TechnoPharm 9, Nr. 1, 30–35 (2019). · Erens S · Testo Industrial Services GmbH, Kirchzarten
Die Etablierung eines Überwachungsplans ist eine der wichtigsten Forderungen der aktuellen DIN EN ISO 14644-2. Bei der Etablierung eines Überwachungsplans ist v. a. seine spätere Handhabbarkeit wichtig. Die Dokumentation muss derart gestaltet sein, dass sie aktiv auf Veränderungen der Leistungsfähigkeit des Reinraums reagieren kann und die verwendeten Daten, Trends und schleichende Veränderungen erkennen lassen. Ein aktives Risikomanagement muss später variabel auf Veränderungen oder neue Erkenntnisse beim Betrieb anpassbar sein. Daher empfiehlt es sich, die grundlegenden und allgemeinen Teile des Plans in einem übergeordneten Dokument (Masterplan) zu regeln. Zudem lassen sich hier auch allgemeine Qualitätssicherungsverfahren wie Change Control oder Abweichungsmanagement in den ...
-
Die klinische Prüfung im Spannungsfeld von Real World Data, Social Media und Datenschutz – Quo vadis?
Rubrik: Tagungsberichte
(Treffer aus pharmind, Nr. 02, Seite 224 (2019))
Die klinische Prüfung im Spannungsfeld von Real World Data, Social Media und Datenschutz – Quo vadis? / Bericht über das 26. Symposium des Bundesverbands Medizinischer Auftragsinstitute (BVMA) e. V. am 23. Nov. 2018 in München · Neuer K, Angenendt A · MLM Medical Labs GmbH, Mönchengladbach
Das 26. BVMA-Symposium startete wieder mit dem voll besuchten Get-together am Vorabend, bevor der nun seit einem Jahr amtierende Vorstandsvorsitzende Martin Krauss, zusammen mit Ralf Freese und Dr. Yvonne Rollinger, das Symposium im Arabella Sheraton in München eröffnete.
Sie sehen Artikel 8651 bis 8660 von insgesamt 11884
- Erste Seite
- 864
- 865
- 866
- 867
- 868
- Letzte Seite