Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Peither T.
In der Rubrik Zeitschriften haben wir 10 Beiträge für Sie gefunden
-
3rd Party GMP-Audits
Rubrik: GMP / GLP / GCP
(Treffer aus pharmind, Nr. 03, Seite 224 (2024))
Peither T | Lakonig S | Oschmann R | Bicane F | Brückner T | Häusler H | Schmitt S | Waldöfner N | Follmann M
3rd Party GMP-Audits / Neue VDI-Expertenempfehlung · Peither T1, Lakonig S2, Oschmann R3, Bicane F3, Brückner T4, Häusler H5, Schmitt S6, Waldöfner N7, Follmann M8 · 1GMP-Verlag Peither AG, Schopfheim und Heacon Service GmbH, Berlin und Bundesverband der Arzneimittel-Hersteller e. V. (BAH), Bonn und Bundesverband der Pharmazeutischen Industrie e. V. (BPI), Berlin und Arbeitsgemeinschaft für pharmazeutische Verfahrenstechnik (APV), Mainz und Parexel Consulting, Uxbridge und Blue Inspection Body GmbH, Münster und Verein Deutscher Ingenieure e. V. (VDI), Düsseldorf
3rd Party GMP-Audit Expertenempfehlung Lieferantenaudit Lieferantenqualifizierung GMP-Audits werden häufig an Dritte ausgelagert, dennoch wird diese Praxis in den Regelwerken nicht ausreichend beschrieben. Die ISO 19011:2018 regelt grundsätzlich das Auditieren von Managementsystemen und die ISO 17020:2012 das Inspektionswesen. Auch die EU-GMP-Guidelines beinhalten klare Aussagen, dass Zulieferer qualifiziert sein müssen. In der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) findet sich im § 11 Abs. 2 [ 2 ] die Anforderung für Wirkstoffe, dass die „ Qualifizierung von Lieferanten […] im Rahmen des QM-Systems des verarbeitenden Betriebs nach schriftlich oder elektronisch festgelegtem Verfahren durchzuführen “ ist. Ferner ist in Abs. 3 zu lesen, dass diese „ Überprüfungen des Herstellers vor ...
-
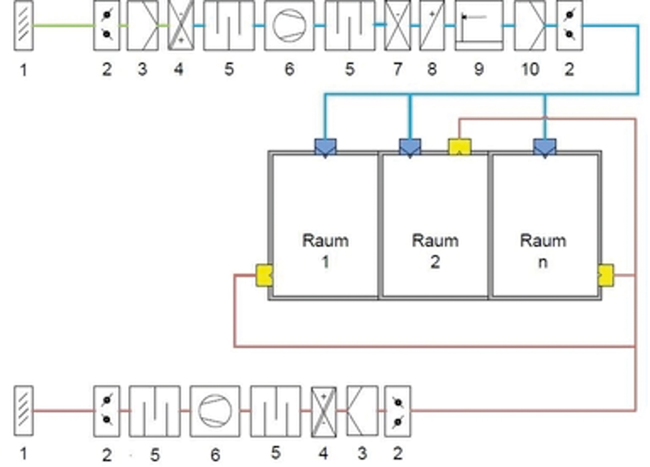
Passgenaue Lösungen für GMP-konforme Reinraumlüftungssysteme
Rubrik: Technik
(Treffer aus cleanroom & processes, Nr. 01, Seite 10 (2022))
Passgenaue Lösungen für GMP-konforme Reinraumlüftungssysteme / Flechl und Peither • Reinraumlüftungssysteme · Flechl H, Peither T · Freiberuflicher Fachautor, Wien (Österreich) und GMP-Verlag Peither AG, Schopfheim
Reinräume Lüftungsanlagen GMP-Anforderungen Lüftungskonzepte Praxisbeispiele Die jeweilige Konzeption und der Aufbau der raumlufttechnischen Systeme ergeben sich aus den Anforderungen und Gegebenheiten, die an den Reinraum gestellt werden. Neben der funktionellen Beschreibung (z. B. was muss die Anlage bewirken, was muss sie können) sollten folgende Informationen bekannt sein: die äußeren Bedingungen und Gegebenheiten des Standortes, die Anforderungen an die Räumlichkeiten, die Einflussfaktoren aus der Produktion, die das Raumklima und die Partikel-/Keimabgabe beeinflussen können und die vom Layout abhängigen Anforderungen. Bei der Auswahl des zum Einsatz kommenden Systems können folgende Kriterien eine Rolle spielen: Einfluss der Außenluft klimatische Bedingungen des Standortes Betriebskosten der ...
-
Qualifizierungsmasterplan
Rubrik: GMP-Aspekte in der Praxis
(Treffer aus pharmind, Nr. 02, Seite 269 (2017))
Qualifizierungsmasterplan / Regulatorische Anforderungen und Inhalte · Peither T · Maas & Peither AG
Alle Qualifizierungsaktivitäten müssen schriftlich dokumentiert werden, da sie ansonsten nicht nachvollziehbar sind. Die Qualifizierungsdokumentation besteht aus dem Qualifizierungsmasterplan (QMP) und den Qualifizierungsplänen und -berichten. In diesem Auszug werden regulatorische Anforderungen und Inhalte eines QMP beschrieben und 2 Arten von Change Control unterschieden.
-
Es gibt 7 weitere Treffer zu Ihrer Anfrage[ Alle Treffer dieser Rubrik anzeigen ]