PDCO – News | Beitrag aus pharmind 87 | Nr. 6 | Seite 525-527 (2025)
11.07.2025Der Ausschuss für Kinderarzneimittel (Paediatric Committee, PDCO) ist ein wissenschaftliches Gremium der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA), das die eingereichten ...
GenNext Technologies und Thermo Fisher Scientific arbeiten zusammen
11.07.2025GenNext® Technologies, Inc., ein Pionier auf dem Gebiet des Protein-Footprinting, arbeitet mit Thermo Fisher Scientific zusammen, um einen vereinfachten strukturbiologischen Arbeitsablauf ...
IMCD eröffnet in Shanghai ein neues Life-Science-Laborzentrum
11.07.2025Die IMCD Group, ein weltweit führendes Unternehmen im Vertrieb und der Formulierung von Spezialchemikalien und -inhaltsstoffen, gibt die offizielle Eröffnung ihres neu organisierten und erweiterten ...
ACG strengthens its engineering leadership with appointment of Nikhil Kulkarni as CEO
11.07.2025ACG Engineering, a division of ACG, the world's only integrated pharmaceutical solutions and manufacturing company, has announced the appointment of Nikhil Kulkarni as the Group CEO of ACG ...
meistgelesen
Beitrag aus der Ausgabe 1/2025 der Zeitschrift pharmind
Optimierung analytischer Methodentransfers
Eine herausfordernde Aufgabe und wie diese erfolgreich gemeistert werden kann
Analytische Transfers sind Aktivitäten, deren Einfluss auf die Routineanalytik nicht hoch genug eingeschätzt werden kann. Neben Aspekten des „reinen GMP“ sind die gewissenhafte inhaltliche Vorbereitung und erfolgreiche Durchführung auch ein wichtiger betriebswirtschaftlicher Aspekt, da eine unzuverlässige Analytik zu finanziellen Verlusten führen kann sowie unnötig Ressourcen im Abweichungsmanagement und bei der Fehlersuche bindet. ...
Beitrag aus der Ausgabe 2/2025 der Zeitschrift pharmind
CMC und GMP – Update
Analytische Verfahrensentwicklung und Validierung in der Qualitätskontrolle – Teil 1
Die Entwurfsfassungen beider Leitlinien ICH Q2 „Guideline on validation of analytical procedures“ und ICH Q14 „Analytical Procedure Development“ wurden in zurückliegenden Beiträgen dieser Publikationsreihe bereits umfassend kommentiert [1,2]. Dabei wurden auch eine ganze Reihe von Inkonsistenzen dargestellt und Regelungsinhalte kommentiert, die man als nicht sachgerecht und/oder nicht dem Stand von ...
Beitrag aus der Ausgabe 1/2025 der Zeitschrift pharmind
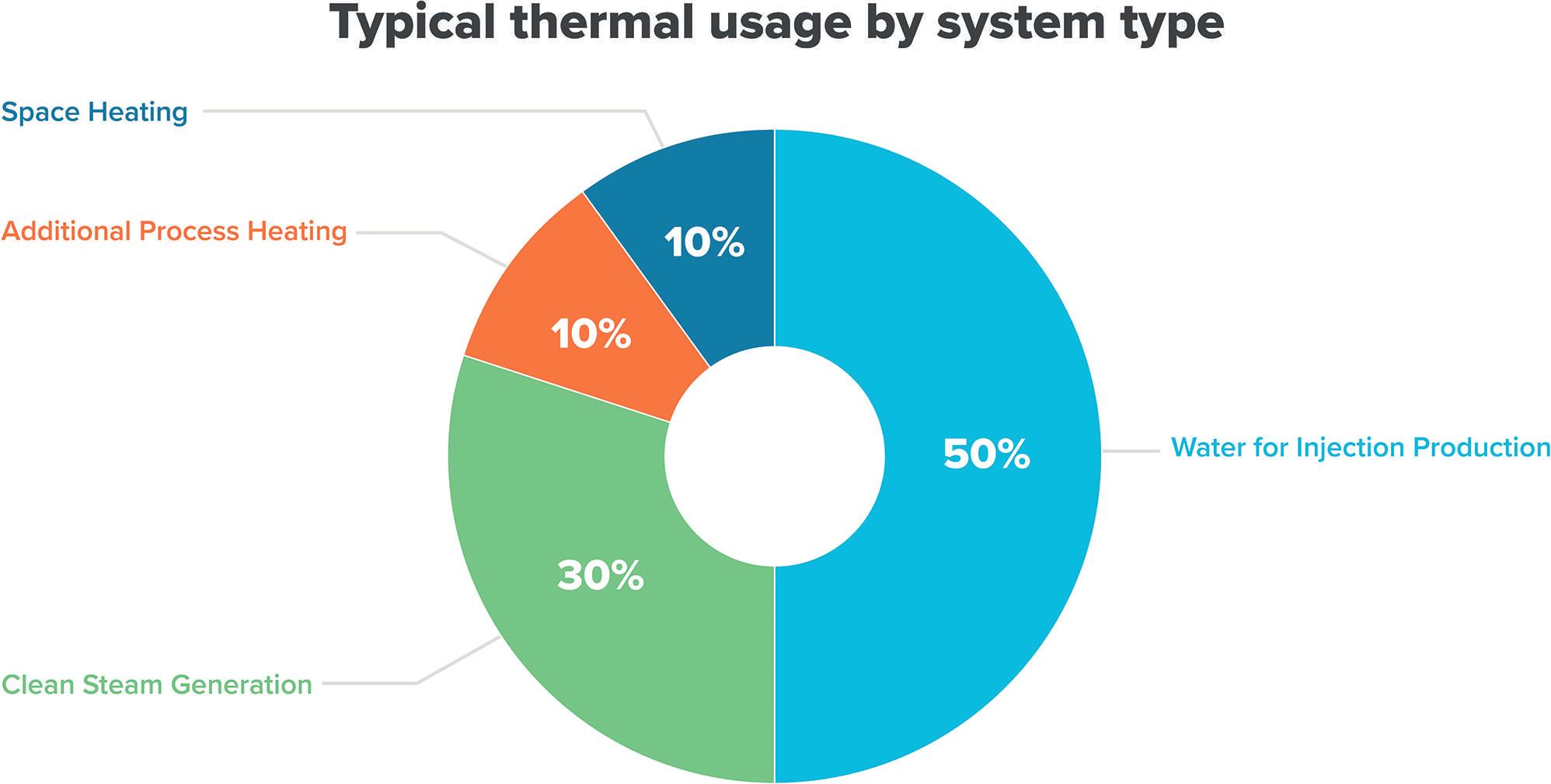
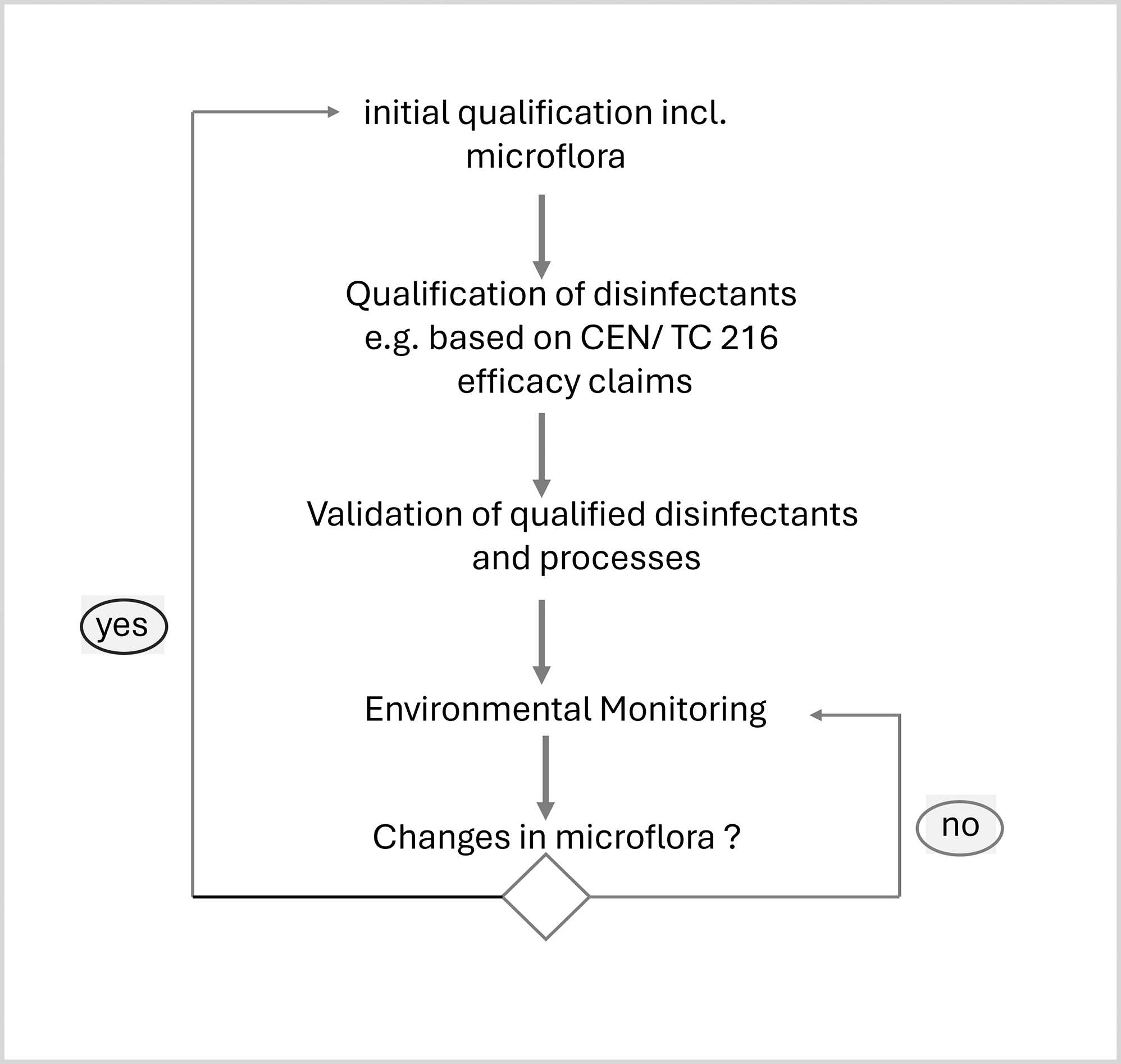
Betrieb und Instandhaltung von Wassersystemen
Teil 2: Wartung, Kalibrierung und Requalifizierung*Teil 1 dieses Beitrags s. Pharm. Ind. 2024;86(11):1033–1037.
Während des normalen Betriebs muss eine Pharmawasseranlage kontinuierlich überprüft und regelmäßig gewartet werden, damit der qualifizierte Zustand erhalten bleibt. Dazu muss beachtet werden, dass die Anlage einem technischen Verschleiß unterworfen ist und die Messwerte von den tatsächlichen Werten abweichen können. Um diesen Störeinflüssen zu begegnen, sollten regelmäßige Wartungen an der Anlage und Kalibrierungen der Messstellen vorgesehen ...
Branchenposter
Top Themen
Beitrag aus der Ausgabe 6/2025 der Zeitschrift pharmind
GxP-konforme Open-Source-Software für Pharma 4.0
Teil 1: Architektur und Design der Data Computation Platform
Die 4. industrielle Revolution, auch bekannt als Industrie 4.0, zielt darauf ab, die Information Technology (IT) und Operational Technology (OT) zu verbinden. Dadurch entstehen stark automatisierte und intelligente Produktionssysteme, die sowohl die Flexibilität als auch den Produktdurchsatz erhöhen und letztlich die Kosten senken [1]. Zudem fordern Gesundheitsbehörden pharmazeutische Hersteller auf, diesen neuen ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 7/2025 der Zeitschrift pharmind
(erscheint am 31.07.2025)
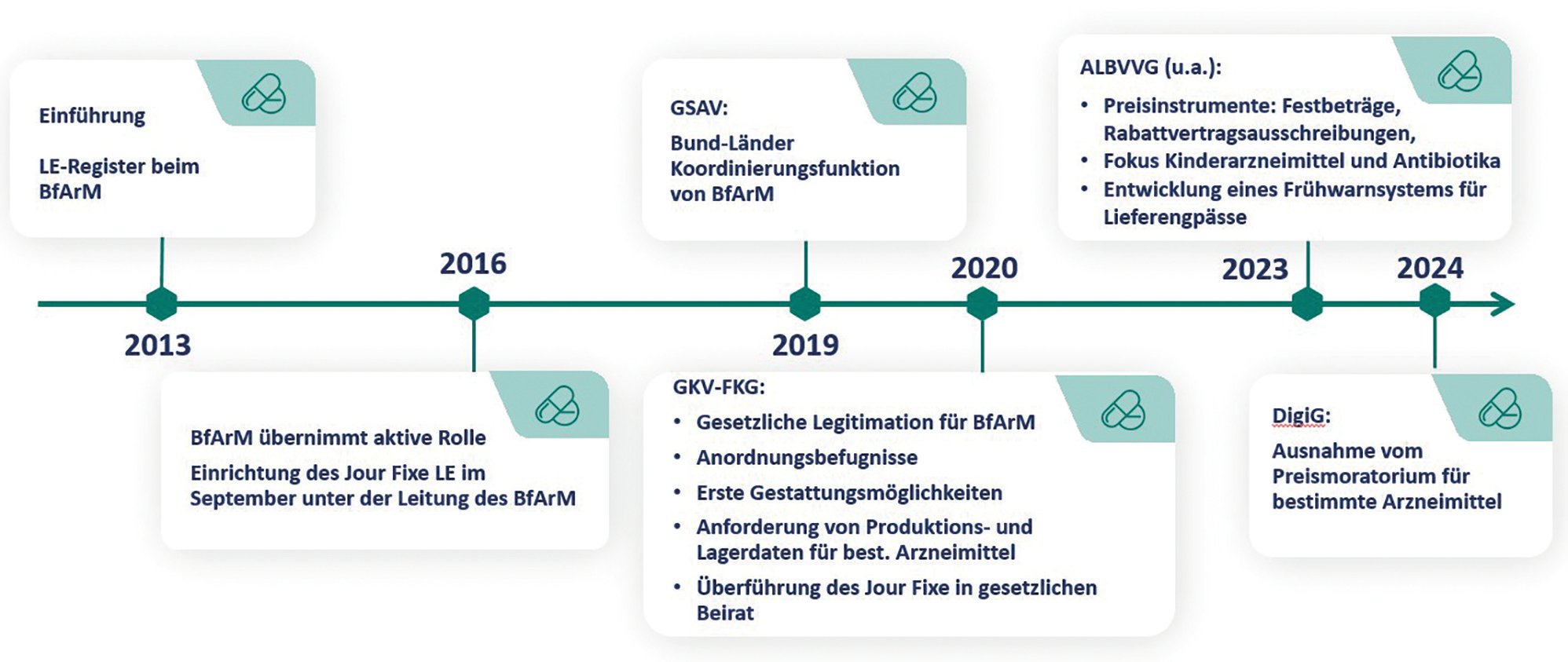
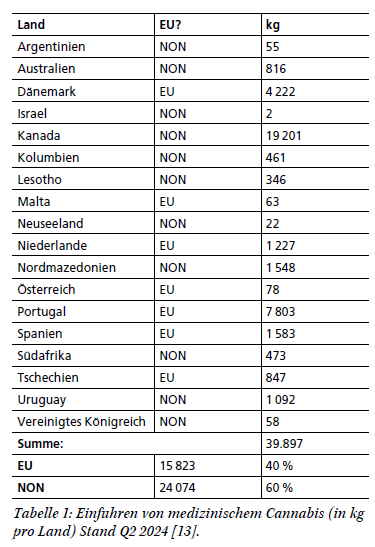
Cannabis-Logistik | Herausforderungen und Chancen nach Inkrafttreten des Medizinal-Cannabisgesetzes
Seit Apr. 2024 unterliegt die Verordnung von Cannabisarzneimitteln im Rahmen des Medizinal-Cannabisgesetzes (MedCanG) nicht länger dem Betäubungsmittelgesetz (BtMG) bzw. der Betäubungsmittelverschreibungsverordnung (BtMVV). Damit sind einige Anforderungen hinsichtlich Lagerung, Handling und Transport sowie der Abgabe von Cannabis-Produkten entfallen, jedoch können spezialisierte Logistikdienstleister aus dem Betäubungsmittelbereich bei der Vermeidung von gesetzlichen Fallstricken und Schwierigkeiten unterstützen. Der Beitrag blickt auf die Entwicklungen der Cannabis- und BtM-Logistik zurück und zeigt aktuelle Herausforderungen auf, mit Fokus auf dem Erhalt der MedCanG-Erlaubnis sowie dem Import aus dem Nicht-EU-Ausland.