Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Riekert D.
In der Rubrik Zeitschriften haben wir 2 Beiträge für Sie gefunden
-
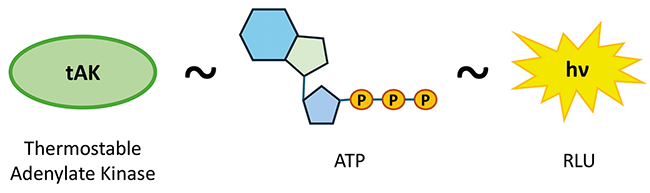
Enzyme indicators for H2O2 biodecontamination
Rubrik: Reinigung & Desinfektion
(Treffer aus cleanroom & processes, Nr. 03, Seite 156 (2024))
Riekert D | Schmid A | Demmler A | Bernhard L
Enzyme indicators for H2O2 biodecontamination / Influence of temperature and humidity · Riekert D1,2, Schmid A2, Demmler A1, Bernhard L1 · 1Optima pharma containment GmbH, Radolfzell-Stahringen und Hochschule Albstadt-Sigmaringen, Sigmaringen
Biodecontamination Isolator Enzyme Indicators Biological Indicators Aseptic Processing The aim of manufacturing sterile pharmaceuticals is to ensure the absence of viable microorganisms through reproducible process design. Both the European [ 1 ] and the United States Pharmacopoeia (USP) [ 2 ] as well as recommendations of the European Medicines Agency (EMA) [ 3 ] call for terminal sterilization in the final container as the method of choice, combined with a sterility assurance level (SAL) of 10 -6 or lower as a recognized acceptance criteria. The SAL value defines the probability of viable microorganisms remaining in the product batch after the ...
-
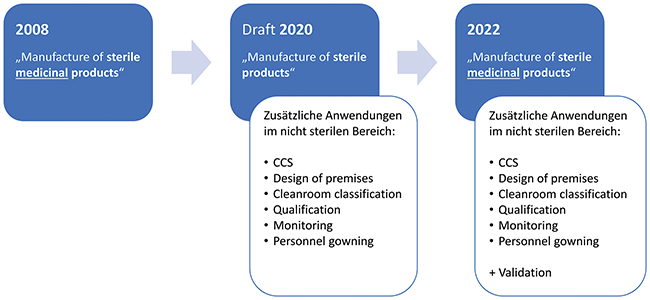
GMP-Monitoringsysteme
Rubrik: Regularien
(Treffer aus cleanroom & processes, Nr. 02, Seite 80 (2023))
Riekert D | Schmid A | Poloczek S
GMP-Monitoringsysteme / Regulatorische Neuerungen im Annex 1 (2022) des EU-GMP-Leitfadens · Riekert D, Schmid A, Poloczek S · Hochschule Albstadt-Sigmaringen, Sigmaringen und Briem Steuerungstechnik GmbH, Nürtingen
Reinraum GMP-Monitoring Annex 1 Kontaminationskontrolle Trending Als einer von 21 Anhängen des EU-GMP-Leitfadens legt der Annex 1 die regulatorischen Grundlagen für die Herstellung von sterilen Arzneimitteln, d. h. terminal sterilisierte sowie aseptisch hergestellte Produkte, fest. Mit der Veröffentlichung der neuen Fassung am 25. Aug. 2022 [ 1 ] wurde der nahezu 5 Jahre umfassende Prozess zur grundlegenden Überarbeitung des Annex 1 erfolgreich abgeschlossen. Die Neufassung enthält wesentliche inhaltliche Neuerungen, wie z. B. die Berücksichtigung fortschreitender technologischer Entwicklungen, Einführung der Kontaminations-Kontrollstrategie (Contamination Control Strategy, CCS) sowie die Integration der ICH–Guidelines Q9 (Quality Risk Management, QRM) und Q10 (Pharmaceutical Quality System, PQS). Der Titel und somit der Anwendungsbereich wurde ausgehend von der Version ...