Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Schüpferling N.
In der Rubrik Zeitschriften haben wir 3 Beiträge für Sie gefunden
-
Lifecycle-Risikomanagement
Rubrik: GMP / GLP / GCP
(Treffer aus pharmind, Nr. 05, Seite 660 (2016))
Gübitz B | Schüpferling N | Khinast J
Lifecycle-Risikomanagement / Modell des objektorientierten Risikomanagements zur praxisgerechten Umsetzung des Qualitätsrisikomanagements über den Produktlebenszyklus von Arzneimitteln und Medizinprodukten · Gübitz B, Schüpferling N, Khinast J · 1VTU Engineering GmbH, Raaba-Grambach (Österreich) und 2gempex GmbH, Mannheim und 3Technische Universität Graz, Graz (Österreich) und 4Research Center Pharmaceutical Engineering GmbH, Graz (Österreich)
Im Arzneimittel- und Medizinproduktebereich ist Qualitätsrisikomanagement über den gesamten Produktlebenszyklus – also von der Entwicklung bis hin zur Anwendung von Arzneimitteln und Medizinprodukten – gesetzlich gefordert. Nicht zuletzt durch die im Okt. 2015 veröffentliche Revisionen des Anhangs 15 zum EU-GMP-Leitfaden gewinnt das Thema Lifecycle-Risikomanagement im Pharma- und Medizinproduktebereich immer mehr an Bedeutung.
-
Validierung der aseptischen Prozessführung in der biotechnologischen Herstellung
Rubrik: GMP / GLP / GCP
(Treffer aus pharmind, Nr. 11, Seite 1742 (2013))
Validierung der aseptischen Prozessführung in der biotechnologischen Herstellung / Eine differenzierte Betrachtung des Begriffs und der Herangehensweise · Schüpferling N, Eckert H · gempex GmbH, Mannheim
Die Validierung von Herstellungsprozessen ist eine der tragenden Stützen der pharmazeutischen Qualitätssicherung. Bei der Herstellung und Abfüllung von sterilen Arzneimitteln ist die Validierung der aseptischen Prozessführung konkret der Nachweis dafür, dass ein Prozess innerhalb einer Produktionseinheit reproduzierbar ein steriles Endprodukt liefert, und ist damit ein mitentscheidender Teil der Gesamtaufgabe. Die Vorgehensweise ist dabei mit der bei den sogenannten „Media Fills“ gleichzusetzen, die ebenfalls auf eine grundlegende GMP-Anforderung zurückzuführen und im fortlaufenden Herstellungsbetrieb zweimal pro Jahr zu leisten sind.
-
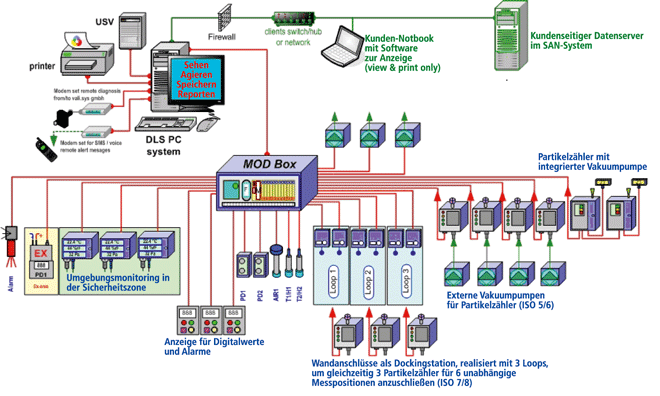
Partikelmonitoring in pharmazeutischen Reinräumen – ein „Update“
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 01, Seite 22 (2011))
Blattner J | Schüpferling N | Eckert H
Partikelmonitoring in pharmazeutischen Reinräumen – ein „Update“ / Eckert, Blattner und Schüpferling • Partikelmonitoring · Blattner J, Schüpferling N, Eckert H · BSR Ingenieur-Büro, Oberhausen-Rheinhausen und gempex GmbH, Mannheim und gempex GmbH, Mannheim
Der Betrieb von reinen Räumen ist eine der Grundanforderungen, die die pharmazeutische Industrie an die Herstellung von aseptischen Arzneimitteln stellt. Die erforderliche Reinheitsklasse der Räume wird aus der Spezifikation des Arzneimittels und der Herstelltätigkeit abgeleitet. Entsprechende Vorgaben sind über den EU-GMP-Leitfaden [ 1 ] verbindlich definiert. In einem pharmazeutischen Prozess werden die Anforderungen an die Umgebungsbedingungen mit der Nähe zum Endprodukt hin strikter. Sie sind über die Raumtemperatur, die relative Feuchte, den Differenzdruck, die Keim- und die Partikelbelastung und in Reinraumklasse A bzw. in Bereichen mit laminarer Luftströmung zusätzlich über die Luftgeschwindigkeit ausgewiesen und werden über die in den Räumen ...