Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Spiller S.
In der Rubrik Zeitschriften haben wir 4 Beiträge für Sie gefunden
-
Prüfmittelmanagement im GxP-regulierten Umfeld
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 01, Seite 26 (2023))
Gutmann H | Meister M | Spiller S
Prüfmittelmanagement im GxP-regulierten Umfeld / Anforderungen & Umsetzung – Teil 2*Teil 1 dieses Beitrags ist erschienen in TechnoPharm 12, Nr. 5, 254-258 (2022). · Gutmann H, Meister M, Spiller S · Testo Industrial Services GmbH, Kirchzarten
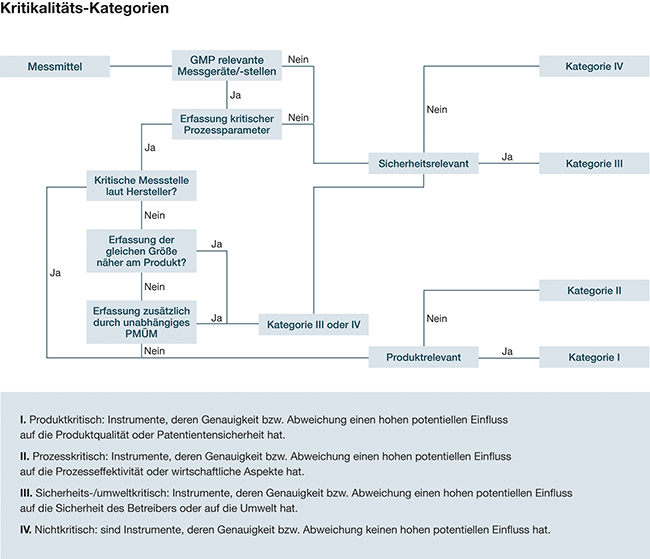
Bevor die Prüfmittelidentifizierung und die Messtellenrisikoanalyse inklusive der Kalibrierintervallbestimmung vorgenommen werden, sollten vorab Einstufungskriterien für die Bestimmung der Kritikalität der Messmittel festgelegt werden. Mit gut durchdachten Kriterien muss später bei Neuanschaffungen von Messmitteln der Einstufungsprozess nicht jedes Mal neu gestartet werden und der Bearbeitungsaufwand verringert sich. Hierbei ist zu beachten, dass zu grobe Betrachtungen, wie das Auslassen (in der Betrachtung) eines nachgeschalteten Prozesses, zu einer möglicherweise zu „harten“ Eingruppierung (Klasse I statt II) führen könnten, wodurch der wirtschaftliche Vorteil und die Effizienz des Entscheidungsschemas wieder verringert werden würden. Abbildung 2 zeigt ein mögliches Beispiel für ein solches Einstufungsschema. Hier wird durch Ja/Nein-Fragen die ...
-
Prüfmittelmanagement im GxP-regulierten Umfeld
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 05, Seite 254 (2022))
Gutmann H | Meister M | Spiller S
Prüfmittelmanagement im GxP-regulierten Umfeld / Anforderungen & Umsetzung – Teil 1 · Gutmann H, Meister M, Spiller S · Testo Industrial Services GmbH, Kirchzarten
GxP-konformes Prüfmittelmanagement Kalibriermanagement GAMP Automatisierte Prüfmittelmanagementsysteme Ein funktionierendes Prüfmittelmanagementsystem und ein effizientes Kalibriermanagement sind nicht nur Voraussetzung für richtige Messungen und damit korrekte Entscheidungen in einem Unternehmen, sondern auch eine grundlegende Anforderung aus dem Qualitätsmanagement. Das Prüfmittelmanagement berücksichtigt dabei den gesamten Lebenszyklus des Messmittels – von der Beschaffung bis hin zur Außerbetriebnahme. Innerhalb dieses Lebenszyklus bildet die regelmäßige Rekalibrierung den Schlüssel für eine geeignete metrologische Rückführung. Die große Bedeutung dieser Thematik spiegelt sich in allen relevanten Qualitätsmanagementnormen und -leitfäden des Good-Manufacturing-Practice(GMP)-Compliance-Umfelds wider. In der ISO 9001:2015 [1] wird im Kapitel „Ressourcen zur Überwachung und Messung“ die grundlegende Forderung nach einem systematischen ...
-
Validierung von computergestütztem Equipment
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 04, Seite 230 (2020))
Validierung von computergestütztem Equipment / Beachtung der Datenintegrität im GMP-Bereich – Teil 2*Teil 1 dieses Beitrags ist erschienen in TechnoPharm 10, Nr. 3, 172–175 (2020). · Spiller S · Testo Industrial Services, Kirchzarten
Prinzipiell können die Maßnahmen zum Schutz der Datenintegrität auf 2 Ebenen umgesetzt werden: Technische Ebene: Hierzu gehören technische Umsetzungen zur Automatisierung und technische Kontrollen durch das computerisierte System. Der technische Maßnahmenkatalog sollte zusätzlich IT-Lösungen beinhalten. Das effektivste Mittel, um v. a. unbeabsichtigte und unkontrollierte Änderungen an Daten zu verhindern, sind technische Maßnahmen. Dennoch sind organisatorische Maßnahmen notwendig, um das System konform zu betreiben und bestehende Risiken zu mindern. Prozedurale/organisatorische Ebene: Zu den organisatorischen Maßnahmen gehören z. B. Vorschriften und Anweisungen sowie die notwendigen Schulungen. Zusätzlich sollten Freigabe- und Genehmigungsprozesse sowie Review-Prozesse bzw. periodische Evaluierungen etabliert werden. Grundsätzlich sollten diese Prozesse regelmäßig überwacht werden, ...
-
Es gibt 1 weitere Treffer zu Ihrer Anfrage[ Alle Treffer dieser Rubrik anzeigen ]
In der Rubrik Bücher haben wir 2 Bücher für Sie gefunden
-
GMP-/FDA-gerechte Validierung
(Treffer aus Büchern)
Validierung und Qualifizierung sind unumgänglich in der pharmazeutischen Industrie: In der 4., überarbeiteten und erweiterten Auflage bietet die ptj-Ausgabe GMP-/FDA-gerechte Validierung hier einen aktuellen und umfassenden Überblick. ... -
GMP-/FDA-gerechte Validierung | PDF
(Treffer aus Büchern)
Validierung und Qualifizierung sind unumgänglich in der pharmazeutischen Industrie: In der 4., überarbeiteten und erweiterten Auflage bietet die ptj-Ausgabe GMP-/FDA-gerechte Validierung hier einen aktuellen und umfassenden Überblick. ...