Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Aseptische Regelung von kleinen Mengen
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 106 (2016))
Aseptische Regelung von kleinen Mengen / Stark und Knecht • Aseptische Regelung · Stark C, Knecht M · GEMÜ Gebr. Müller Apparatebau GmbH & Co. KG, Ingelfingen
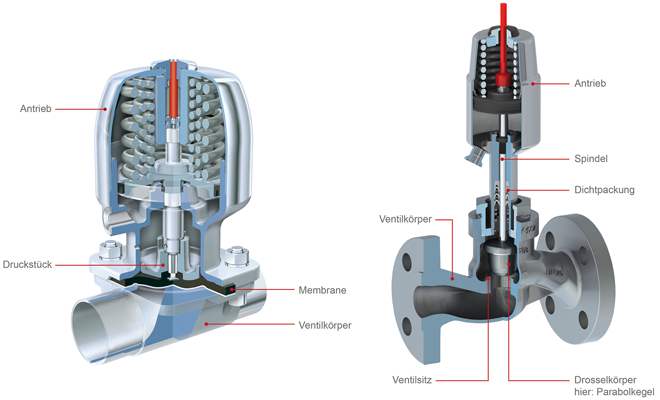
aseptisch Regelventil Sitzventil Kleinmengen Membrane Die Anforderungen an die Reinheit und Qualität von Medikamenten sind in den letzten Jahrzehnten enorm gestiegen. Die Prozesse in der Pharmaproduktion sollen immer noch exakter und noch hygienischer sein. Dadurch sind zum einen eine längere Haltbarkeit und höhere Qualität möglich und zum andern können die strengen Vorschriften und Zulassungsbedingungen eingehalten werden. Selbst in Bereichen, in denen bisher keine aseptischen Ventile eingesetzt wurden, werden mittlerweile vermehrt Aseptikventile gefordert. Sollen nun sehr kleine Mengen zudosiert werden, wird die Wahl des richtigen Ventils schwierig. Ein Membranventil (vgl. Abb. 1 , links) ist die erste Wahl, wenn ein aseptisches Ventil ...
-
Anwendung und Vergleich unterschiedlicher Dissolutionmethoden
Rubrik: Analytik
(Treffer aus TechnoPharm, Nr. 02, Seite 112 (2016))
Anwendung und Vergleich unterschiedlicher Dissolutionmethoden / Auswahl von Medien für die Freisetzungsprüfung oraler Darreichungsformen – Teil 1 · Klein S · Ernst-Moritz-Arndt Universität, Greifswald
biorelevante Freisetzungsmedien Gallensalze Lecithin synthetische Tenside Bioverfügbarkeit Wie bereits in einem früher erschienenen Beitrag [1] diskutiert wurde, hat sich der Einsatzbereich von Freisetzungsprüfungen im Laufe der letzten Jahre stark verändert. Besonders für orale Darreichungsformen gehören Dissolutiontests heutzutage zu den wichtigsten Prüfmethoden für pharmazeutische Darreichungsformen und werden inzwischen nicht nur für die Qualitätskontrolle, sondern mehr und mehr auch in den frühen Phasen der Formulierungsentwicklung eingesetzt. Gerade wegen der Vielfalt der Einsatzmöglichkeiten dieser Testmethoden stellt sich neben der Auswahl des geeigneten Gerätes immer wieder die Frage, welches Freisetzungsmedium für welchen Zweck einzusetzen ist. Diese Frage ist alles andere als trivial, da die ...
-
POWTECH 2016
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 118 (2016))
POWTECH 2016 / Sonderteil POWTECH
Im Messezentrum Nürnberg wird vom 19. bis 21. 04.2016 die Messe POWTECH 2016 ausgerichtet. Diese Leitmesse für mechanische Verfahrenstechnik, Analytik und Handling von Pulver und Schüttgut bedient eine große Bandbreite von Wirtschaftssektoren: von der Pharma-, Chemie- und Nahrungsmittelbranche bis zur Glas-, Baustoff- und Papierindustrie. Die rund 900 Aussteller fokussieren sich vor allem auf den Umgang mit Stoffen: Analysieren, Zerkleinern, Sieben, Mischen, Fördern, Lagern, Dosieren und Kompaktieren. Produkte und Dienstleistungen für alle Aspekte der Pharmaproduktion werden über 375 Aussteller den Besuchern präsentieren. Nach der Integration der ehemals parallel stattfindenden Messe TechnoPharm in die POWTECH werden sich diese über alle 6 Messehallen ... -
Gebr. Lödige Maschinenbau
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 120 (2016))
Gebr. Lödige Maschinenbau / Sonderteil POWTECH
Die Gebr. Lödige Maschinenbau GmbH *) ist mit über 500 Patenten und mehr als 30 000 ausgelieferten Maschinen ein weltweit führender Anbieter von Maschinen und Systemen für industrielles Mischen und verwandte Verfahrenstechnologien von Feststoffen, Granulaten, Pulvern, Stäuben, Pasten und Schlämmen. Lösungen von Lödige kommen in allen Branchen zum Einsatz, von der Bau- und Chemiebranche über Kosmetik, Kunststoff und Metallurgie bis hin zu Nahrungsmitteln, Organischen Stoffen, Pharma oder Umwelt. Lödige wurde 1938 in Paderborn gegründet und befindet sich noch heute in Familienbesitz. Besuchen Sie uns auf der POWTECH Halle 1, Stand 1-517. Vertriebskontakt: Reiner Lemperle Tel.: +49-5251-309-371 Fax: +49-5251-309-129 e-mail: lemperle@loedige.de ... -
M+W Central Europe
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 120 (2016))
M+W Central Europe / Sonderteil POWTECH
M+W Central Europe GmbH *) , ein Tochterunternehmen der M+W Group, ist ein international führendes Unternehmen für Planung, Engineering und Errichtung von komplexen Produktionsanlagen und Gebäuden in den Branchen Pharma, Biotechnologie, Chemie, Medizinprodukte, Kosmetik, Consumer Care und Food. Das Leistungsportfolio umfasst effiziente, nachhaltige Lösungen und Services von der Konzeptstudie und integrierten 3D-Planung bis hin zur schlüsselfertigen Realisierung von komplexen und nachhaltigen Prozessanlagen und Gebäuden. Die Projektrealisierung von Neu- und Umbauten oder Erweiterungen kann von M+W Central Europe als Generalplaner oder schlüsselfertig als Generalunternehmer professionell umgesetzt werden. Die Anforderungen unserer Kunden stehen von Anfang an im Mittelpunkt. Integrierte Projektteams entwickeln weltweit ... -
Schneller Produktwechsel in der Tablettierung mit der Tablettenpresse FE35
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 121 (2016))
Schneller Produktwechsel in der Tablettierung mit der Tablettenpresse FE35 / Sonderteil POWTECH
Pharmaproduzenten, die auch in Zukunft wettbewerbsfähig bleiben wollen, müssen sich auf unterschiedliche Produktionsszenarien einstellen. Hierbei sind eine schnelle und flexible Fertigung, kurze Umrüstzeiten und eine hohe Anlagenverfügbarkeit gefragt. Auf diese Anforderungen hat Fette Compacting *) die Tablettenpresse FE35 ( Abb. 1 ) zugeschnitten. Sie bietet die kürzesten Produktwechselzeiten ihrer Klasse, eine höhere Produktivität und eine einfache Bedienung durch das patentierte TRI.EASY-Design. -
PTA – Spezialist für Reinraumtechnik in der Pharmaindustrie
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 122 (2016))
PTA – Spezialist für Reinraumtechnik in der Pharmaindustrie / Sonderteil POWTECH
Mit über zwanzig Jahren Erfahrung ist die PTA Pharma-Technischer Apparatebau GmbH & Co. KG *) ein führender Anbieter für hochqualitative Laminar-Flow-Anlagen, Reinraumtechnik, Wiegekabinen, Freiarbeitsplätze sowie Reinigungsanlagen und Stopfen-Waschanlagen in Pharma-, Chemie- und Lebensmittel-Industrie. Von Projektierung, Engineering und Entwicklung bis hin zu Lieferung, Montage, Inbetriebnahme und Wartung bietet PTA alles aus einer Hand. Die Kernkompetenz liegt in der Lösung kundenspezifischer Anforderungen „Made in Germany“. Besuchen Sie uns auf der POWTECH in Halle 3, Stand 3-435. -
Der Pharmawasserspezialist
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 122 (2016))
Der Pharmawasserspezialist / Sonderteil POWTECH
Die Letzner Pharmawasseraufbereitung GmbH *) liefert weltweit schlüsselfertige Anlagen zur Herstellung von reinem Wasser und reinem Dampf zur Anwendung in pharmazeutischen Prozessen. Zum Sortiment gehören verschiedene Vorbehandlungseinheiten zur Aufbereitung des Speisewassers wie z. B. pharmakonforme Edelstahlenthärtungsanlagen mit Einzelventilsteuerung, Umkehrosmoseanlagen zur Herstellung von PW, Druckkolonnen-Destillationsanlagen zur Herstellung von WFI sowie Reinstdampferzeuger. Neben der Aufbereitung zum reinen Wasser und Dampf gehört auch deren Lagerung (im Falle des Wassers) und Verteilung bis zur Zapfstelle inklusive aller prozessrelevanten Steuer- und Messinstrumente zum Umfang eines Turnkey-Systems, dessen Gesamtinstallation Sie bei der Firma Letzner beauftragen können. Die Projektierung beinhaltet zudem weitere Prozesse, wie das gesamte Engineering, ... -
Wir gestalten Produktionsprozesse
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 122 (2016))
Wir gestalten Produktionsprozesse / Sonderteil POWTECH
Wellmann Engineering *) setzt seit über 20 Jahren wegweisende verfahrenstechnische Technologien und Anlagen flexibel und engagiert um. Wellmann versteht sich dabei als Problemlöser für Kundenanforderungen und verwirklicht hochkomplexe Projekte mit Spezialisten aus den Bereichen Engineering, Automation und Montage. Profitieren Sie von unserer Erfahrung. -
Trocknungstechnologie:sicher und schonend trocknen
Rubrik: Sonderteil POWTECH
(Treffer aus TechnoPharm, Nr. 02, Seite 123 (2016))
Trocknungstechnologie:sicher und schonend trocknen / Sonderteil POWTECH
„Schnell, schonend und sicher trocknen“ – diesem Leitspruch hat sich der Trocknungsanlagenbauer Harter *) aus Stiefenhofen im Allgäu seit 25 Jahren verschrieben. Die eigens entwickelte „Kondensationstrocknung auf Wärmepumpenbasis“ ist die Lösung für so manche Trocknungsherausforderung. Sie kombiniert scheinbar widersprüchliche Attribute wie niedrige Temperaturen und kurze Trocknungszeiten. Mit der eigens entwickelten Airgenex® – Kondensationstrocknung und ihren Systemvarianten AIRGENEXmed und AIRGENEXfood werden Waren aus Metall, Glas und Kunststoff oder organische Produkte wie Lebensmittel bei niedrigen Temperaturen zwischen 20 °C und 90 °C schonend und stressfrei getrocknet. Durch den Einsatz extrem trockener Luft und einer individuell angepassten Luftführung werden sehr kurze Trocknungszeiten mit gleichzeitig ...
Sie sehen Artikel 6871 bis 6880 von insgesamt 11884
- Erste Seite
- 686
- 687
- 688
- 689
- 690
- Letzte Seite