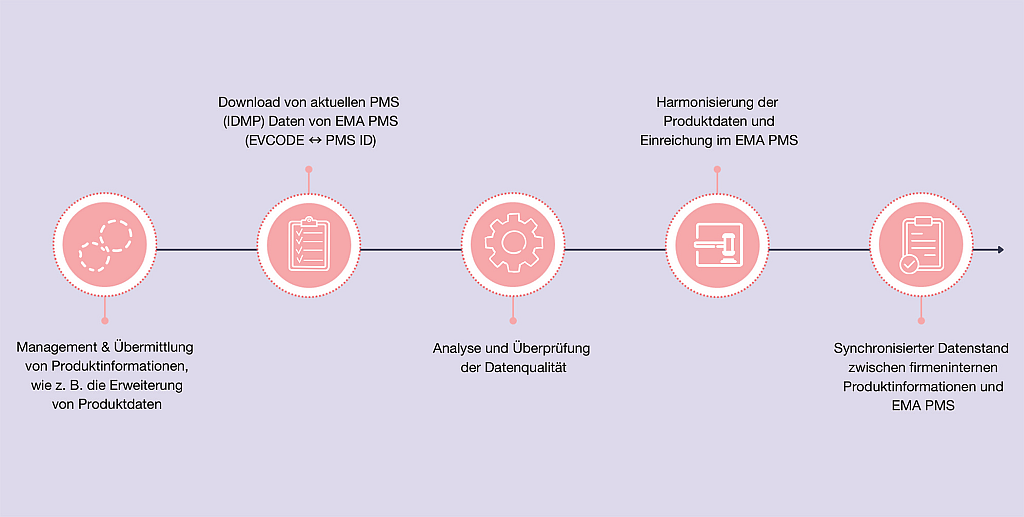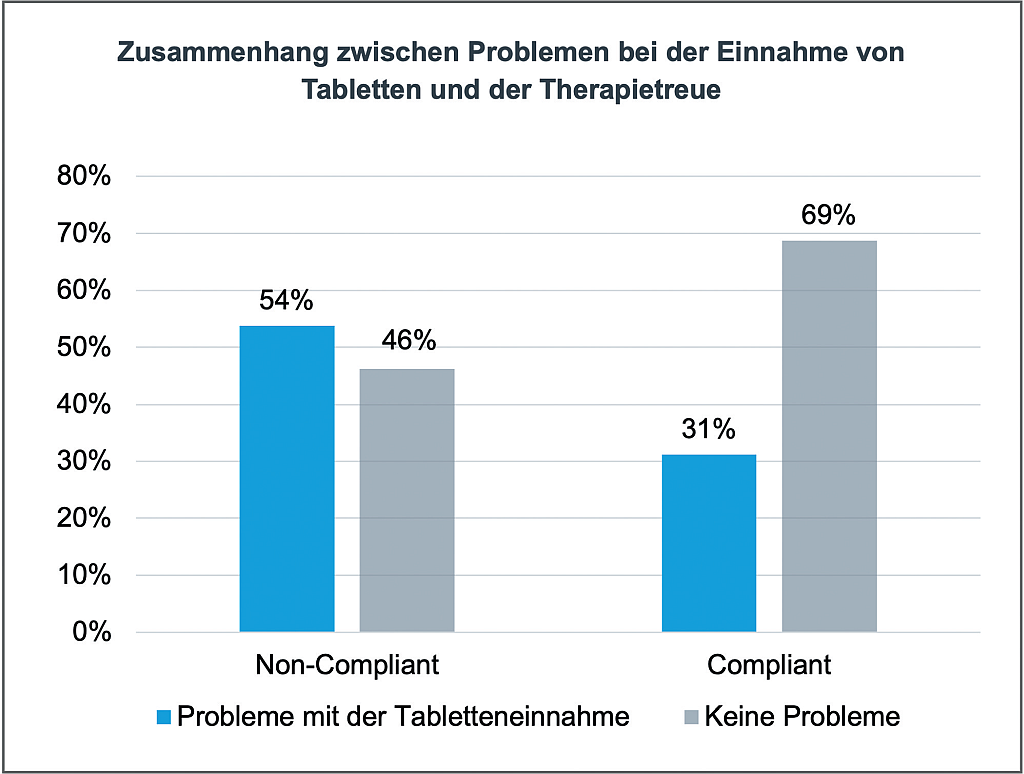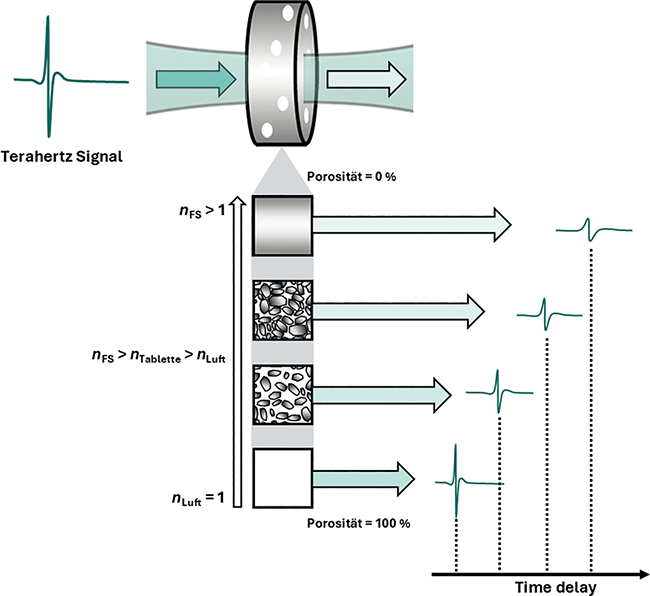
Terahertz-Spektroskopie von Tabletten – Teil 2 | Beitrag aus pharmind 88 | Nr. 1 | Seite 71-77 (2026)
02.03.2026Die Porosität von Tabletten als kritisches Qualitätsmerkmal von Tabletten wurde bereits in Teil 1 dieses Beitrags erläutert. In diesem Teil 2 soll die Terahertz-Zeitbereichsspektroskopie ...
Unterfinanzierung des Großhandels bedroht Arzneimittelversorgung
02.03.2026Die wirtschaftliche Lage des vollversorgenden pharmazeutischen Großhandels wird immer schwieriger. Darum hat der Bundesverband PHAGRO einen dringenden Appell an Bundesgesundheitsministerin Nina ...
Pharmaindustrie verzeichnet 2025 Wachstum trotz wachsender Unsicherheiten
02.03.2026Die deutsche Pharmaindustrie kann für 2025 eine positive Bilanz ziehen. Laut Branchenverband VCI legte die Produktion 4,5 Prozent zu, die Produktivität stieg um 3,7 Prozent. Auch der Umsatz ...
European Herbal Health Products Summit 2026 unterstreicht Bedeutung von Pflanzlichen Arzneimitteln für die Gesundheitsversorgung in Europa
02.03.2026Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil der Gesundheitsversorgung und tragen zur wirtschaftlichen Stärke Europas bei. Das war die zentrale Botschaft des zweiten ...
FSME breitet sich weiter aus - RKI meldet zwei neue Risikogebiete
02.03.2026In vielen Regionen Deutschlands besteht ein hohes Risiko, sich durch einen Zeckenstich mit dem Frühsommer-Meningoenzephalitis (FSME)-Virus zu infizieren. Seit Beginn der Erfassung dieser ...
Neurizon beginnt mit der Dosierung von NUZ-001 in der HEALEY ALS-Plattformstudie
02.03.2026Neurizon® Therapeutics Limited, ein Biotechnologieunternehmen im klinischen Stadium, das sich der Entwicklung innovativer Behandlungen für neurodegenerative Erkrankungen widmet, freut sich bekannt ...
Thomas Biegi leitet ab April 2026 Corporate Communications and Government Relations bei BASF
02.03.2026Thomas Biegi (47) übernimmt zum 1. April 2026 die Leitung der Abteilung Corporate Communications and Government Relations der BASF. Er tritt die Nachfolge von Nina Schwab-Hautzinger an und wird in ...
Mark Garrett soll der Hauptversammlung 2026 zur Wahl in den Aufsichtsrat der BASF SE vorgeschlagen werden
02.03.2026Der Aufsichtsrat der BASF SE hat auf Vorschlag des Nominierungsausschusses Mark Garrett (63) für die Wahl als Anteilseignervertreter im Aufsichtsrat benannt. Die Wahl soll in der ordentlichen ...
Innovativer Campus für Wachstum und Vernetzung: THE PLANT Konstanz
02.03.2026Mit THE PLANT hat sich in Konstanz ein moderner Campus etabliert, der Gewerbemietern aller Art – insbesondere auch Life-Science-Unternehmen - optimale Bedingungen für Entwicklung und Wachstum ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Betrieb computergestützter Systeme
Sandkühler | Computergestützte Systeme
Die rasante Entwicklung der Informationstechnologie hat dazu geführt, dass computergestützte Systeme in nahezu allen industriellen Bereichen eine zentrale Funktion einnehmen. Insbesondere in der pharmazeutischen und biotechnologischen Industrie sind diese Systeme für die Verwaltung und Verarbeitung sensibler Daten, die Steuerung und Überwachung von Produktionsprozessen sowie für die Einhaltung regulatorischer Vorgaben unverzichtbar. Mit der ...
Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
Pflanzliche Arzneimittel unter Druck
Markt, Regulierung und Zukunftsperspektiven – Teil 1
Pflanzliche Arzneimittel (Phytopharmaka) sind ein wichtiger Bestandteil in unserem Gesundheitssystem und haben sich besonders in der Selbstmedikation etabliert. Sie sind leicht verfügbar und eignen sich v. a. für die Behandlung leichter Beschwerden und Erkrankungen. Am häufigsten werden sie als Mittel gegen Erkältungserkrankungen, Magen- und Verdauungsbeschwerden sowie als Beruhigungsmittel eingesetzt [1]. In der Regel zeichnen sich ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Vorschau (Änderungen vorbehalten)
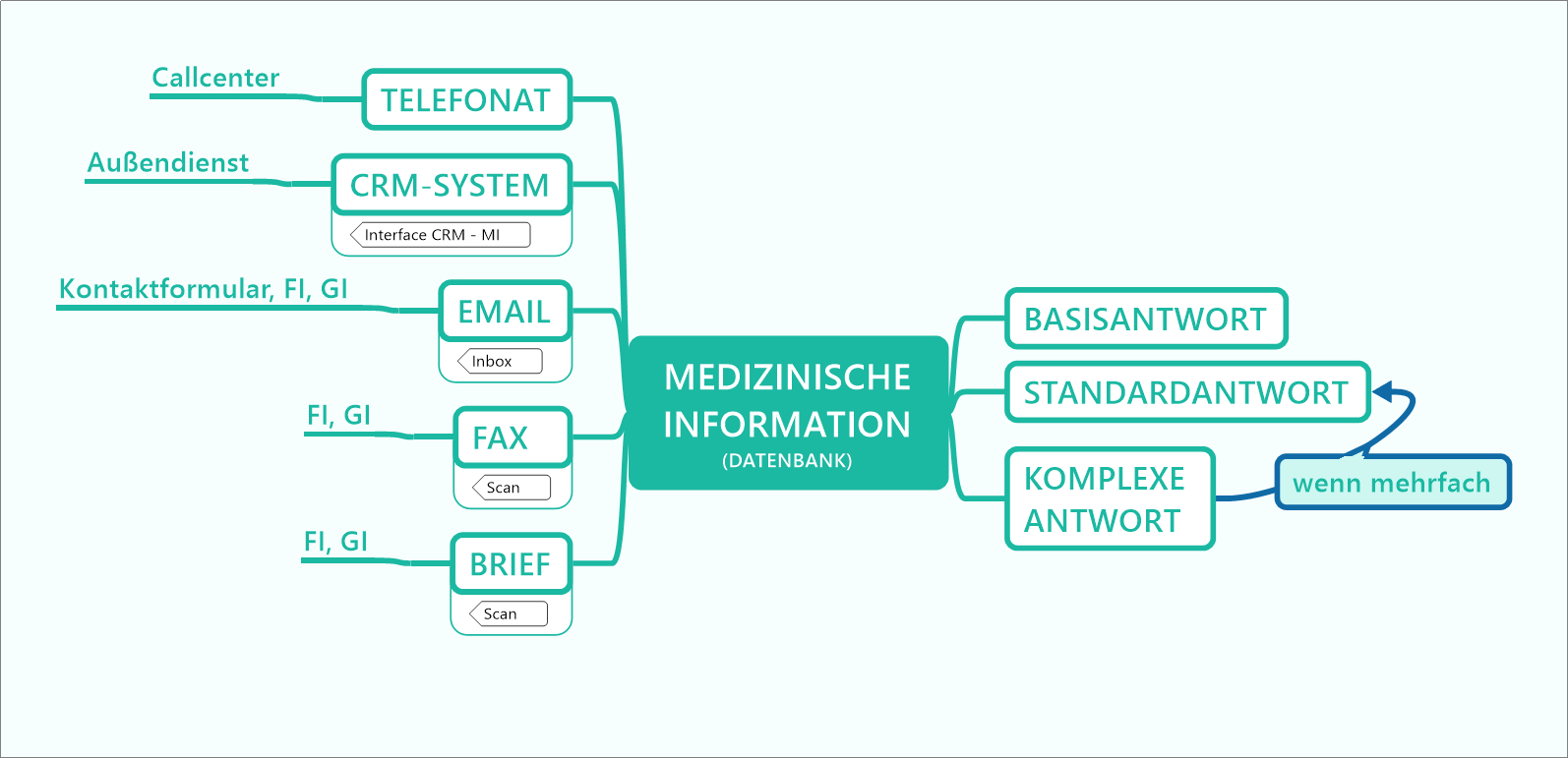
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.