Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Mikrobiologisches Umgebungsmonitoring in der Sterilproduktion
Rubrik: Analytik
(Treffer aus TechnoPharm, Nr. 01, Seite 26 (2015))
Mikrobiologisches Umgebungsmonitoring in der Sterilproduktion / Qualitative Auswertung der identifizierten Mikroorganismen · Rieth M, Krämer N · Merck-Millipore, Darmstadt und Merck-Serono, Darmstadt
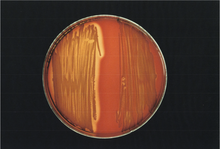
Unter mikrobiologischem Umgebungsmonitoring versteht man ein Programm (bisweilen auch Biocontrol-Programm genannt) zur Erfassung und Beherrschung der Hygienezustände bei der Produktion von Arzneimitteln. Das USP chapter < 1116> sieht dies als ein Schlüsselelement der aseptischen Fertigung an: „Environmental monitoring is one of several key elements required in order to ensure that an aseptic processing area is maintained in an adequate level of control“ [ 1 ]. Dazu werden – einem schriftlichen Monitoring-Plan folgend – die Raumluft, produktberührende und nicht-produktberührende Oberflächen, Räume, Betriebsmittel (Wasser, Gase, Druckluft, Schmiermittel, Reinigungs- und Desinfektionsmittel) und Mitarbeiter (Reinraumkleidung, Handschuhe, Mundschutz) in einem Pharmabetrieb mikrobiologisch untersucht. Zusätzlich wird ein physikalisches ...
-
Kein Arzneimittel ohne Faltschachtel
Rubrik: Arzneimittelwesen
(Treffer aus pharmind, Nr. 01, Seite 26 (2015))
Kein Arzneimittel ohne Faltschachtel / Angerhöfer und Kleissendorf • Faltschachteln · Angerhöfer M, Kleissendorf R · 1Hochschule München, Verpackungstechnik, München und 2PPT-Kleissendorf, Bergisch Gladbach
Die Anforderungen an Faltschachteln für Pharmazeutika haben in der Vergangenheit stets zugenommen und werden auch zukünftig weiter anwachsen. Um die Erfüllung dieser Anforderungen in der betrieblichen Praxis zu gewährleisten, wird es immer wichtiger, die materialspezifischen Besonderheiten von Faltschachteln und die Auswirkungen von Veränderungen auf den gesamten Prozess von der Faltschachtelherstellung bis zum Gebrauch durch den Endabnehmer zu kennen. Dieser Artikel gibt einen Überblick über die wichtigsten Voraussetzungen für einen effizienten Abpackprozess von Faltschachteln, schlägt Lösungsansätze bei auftretenden Problemen vor, weist Optimierungspotenziale auf und zeigt schließlich, welche Anforderungen in Zukunft bei der Spezifikation von Faltschachteln für Arzneimittel zu berücksichtigen sind.
-
Lesermeinung
Rubrik: Diskussionsforum
(Treffer aus pharmind, Nr. 01, Seite 31 (2015))
Lesermeinung / pharmind • Diskussionsforum
Zu dem in der Ausgabe 10/2014 (Pharm. Ind. 2014;74(10):1541-1546) erschienen Beitrag „Pflanzliche Arzneimittel / Verlust einer Tradition mit Therapielücken“ erreichte uns die nachfolgend vollständig wiedergegebene Stellungnahme von Prof. Dr. Eugen J. Verspohl, Westfälische Wilhelms-Universität Münster, Institut für Pharmazeutische und Medizinische Chemie, Abt. Pharmakologie, Münster. Ein Schlusswort der Autoren findet sich im unmittelbaren Anschluss. Stellungnahme zu einer Publikation von Beer A, Schilcher H, Loew D „Pflanzliche Arzneimittel / Verlust einer Tradition mit Therapielücken“ in Pharm. Ind. 2014;74(10):1541-1546. Mit größtem Interesse lese ich immer die Pharm. Ind., meist stimme ich ausdrücklich den Ausführungen zu. Aber diesmal möchte ich Ihnen einen Leserbrief zusenden, ... -
Aktuelles aus G-BA und IQWiG
Rubrik: Gesundheitswesen
(Treffer aus pharmind, Nr. 01, Seite 32 (2015))
Aktuelles aus G-BA und IQWiG / Inkrafttreten der Substitutionsverbotsliste / aktuelle Verfahren der frühen Nutzenbewertung / aktuelle Stellungnahmeverfahren / Ausblick auf die nächsten G-BA-Plenumssitzungen · Lietz C, Wilken M · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Zum 10. Dez. 2014 Beschluss des G-BA vom 18.09.2014 zur Änderung der Arzneimittel-Richtlinie (AM-RL) in Abschnitt M und Anlage VII, Teil B: Bestimmung von Arzneimitteln, deren Ersetzung durch ein wirkstoffgleiches Arzneimittel ausgeschlossen ist (1. Tranche), verkündet im BAnz AT 09.12.2014 B4. Der G-BA hat am 01. Dez. 2014 die Frühbewertungsergebnisse gemäß Paragraph 35a Sozialgesetzbuch V (SGB V) für sieben Arzneimittel veröffentlicht: Apixaban (Eliquis®) – Zulassungserweiterung Das Arzneimittel Eliquis mit dem neuen Wirkstoff Apixaban ist seit Juli 2014 zur akuten Behandlung und Prophylaxe von tiefen Venenthrombosen und Lungenembolien bei Erwachsenen zugelassen. Dementsprechend waren in der Frühbewertung zwei Fragestellungen zu betrachten. ...
-
IT-Sicherheit in Pharmaanlagen
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 01, Seite 34 (2015))
IT-Sicherheit in Pharmaanlagen / FDA 21 CFR part 11 aus Sicht der IT-Sicherheit und weitergehende Maßnahmen zum Schutz von Automatisierungsanlagen · Tebbe C, Niemann K, Runde M · Hochschule Hannover, Hannover
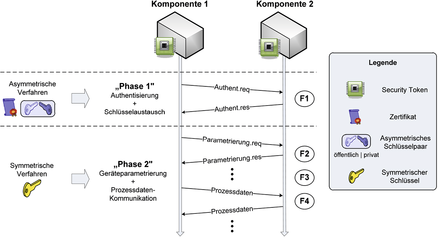
In den letzten Monaten und Jahren stieg die Zahl von IT-Sicherheitsvorfällen und Datenlecks sowie Fällen von Industriespionage im Bereich der (Pharma-)Industrie immer stärker an. Viele Nachrichten und Veröffentlichungen zu diesem Thema [ 9 , 10 , 11 ] zeigen die steigende Relevanz und Notwendigkeit, Produktionsanlagen und deren Netzwerke vor Angriffen von Innen und Außen zu schützen. In der Pharmaindustrie ist neben der Produktionsanlage selbst vor allem das Know-how in Gefahr, welches in den Netzwerken in Form von Rezepten, Vorgehensweisen und Produktionsdaten vorliegt. Um den Herstellern und Betreibern eine Hilfestellung zum Schutz automatisierungstechnischer Anlagen (Automatisierungsanlagen) zu geben, entwickeln viele Vereinigungen und ...
-
Market Access Aktivitäten im Arzneimittel-Vertragsmanagement
Rubrik: Pharma-Markt
(Treffer aus pharmind, Nr. 01, Seite 38 (2015))
Kaiser M | Böhnke A | Staritz M
Market Access Aktivitäten im Arzneimittel-Vertragsmanagement / Einblicke, Bearbeitungsstrategien und die Wahrnehmung durch die Krankenkassen · Kaiser M, Böhnke A, Staritz M · 1Homburg & Partner, Mannheim und 2raptor Pharmaceuticals Germany GmbH, Frankfurt/Main
Eine Zusammenarbeit der pharmazeutischen Unternehmen (pU) und der gesetzlichen Krankenkassen ist seit Jahren in Form von Kooperationen im Bereich des Arzneimittel-Vertragsmanagements bei den meisten Akteuren etabliert. Relevante Rahmenbedingungen dieser Zusammenarbeit werden kontinuierlich durch den Gesetzgeber verändert. Die vielseitigen Anstrengungen der pU von Market-Access (MA) berücksichtigen stets auch die Wahrnehmung der Arzneimittel-Vertragsmanager (AVM) durch die Krankenkassen, um Kooperationen zu unterstützen.
-
Annex 15, Revision 1 – was nun? (Teil 1)
Rubrik: GMP-Regularien
(Treffer aus TechnoPharm, Nr. 01, Seite 40 (2015))
Annex 15, Revision 1 – was nun? (Teil 1) / Gnibl und Peither • Annex 15, Revision 1 – was nun? · Gnibl R, Peither T · Regierung von Oberfranken, Bayreuth und Maas & Peither AG, GMP-Verlag, Schopfheim
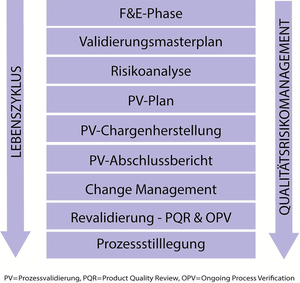
EU-GMP-Leitfaden Anhang/Annex 15 Lebenszyklusmodell User Requirement Specification (URS) Qualifizierung Prozessvalidierung Der Annex 15 „Qualification and Validation“ wird voraussichtlich im ersten Halbjahr 2015 in Kraft gesetzt. Er findet dann verbindliche Anwendung innerhalb der Europäischen Union (EU) und des Europäischen Wirtschaftsraums (EWR). Im Vorfeld wurde zum Annex 15 viel vermutet und falsch interpretiert, daher haben die Autoren hier die wichtigsten Fakten zusammengetragen: Wer bestehende Systeme bereits GMP-konform qualifiziert, braucht nichts zu fürchten. Die bestehende Systematik zur Qualifizierung wurde beibehalten und nur an wenigen Punkten präzisiert oder ergänzt. Der am häufigsten angewendete „3-Chargen-Validierungsansatz“ (traditioneller Ansatz) kann grundsätzlich weitergeführt werden. Mit dem Annex 15 ...
-
Big Pharma at the Crossroads
Rubrik: Pharma-Markt
(Treffer aus pharmind, Nr. 01, Seite 44 (2015))
Müller M | Wenninger
Big Pharma at the Crossroads / Recent strategic moves of globally acting pharmaceutical companies · Müller M, Wenninger1 The views expressed in this article are the views and opinions of the authors b 1 The views expressed in this article are the views and opinions of the authors b · Cepton GmbH, München, Germany
On average, pharma and biotech stocks have shown good performance in 2013, however, most of Big Pharma´s stock price development in 2013 lagged behind the S&P 500 and Dax average. The impact of payors and regulatory bodies continues to grow, influencing not only market access activities, but R&D decisions and business models. Diversification has seen first limits and big players like Abbott, Pfizer and BMS have started to re-focus. Biosimilars and over-the-counter (OTC) drugs have re-entered the spotlight. Regional focus is partly moving on from China to “second-tier” emerging markets like South-East Asia, Iran, Pakistan and Africa. A decrease in ...
-
Biofilme im Pharmawasser verstehen, erkennen und vermeiden
Rubrik: GMP-Praxis
(Treffer aus TechnoPharm, Nr. 01, Seite 46 (2015))
Biofilme im Pharmawasser verstehen, erkennen und vermeiden / Bendlin • Biofilme im Pharmawasser · Bendlin H · Technisches Sachverständigenbüro, Ransbach-Baumbach
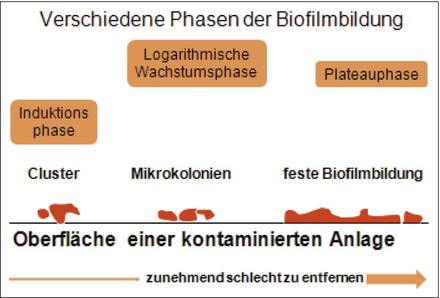
Biofilm Pharmawasser Mikroorganismen Sanitisierung Moderne Pharmawasseranlagen sind problemlos in der Lage, die geforderten chemisch-physikalischen Anforderungen an die Wasserqualität zu erfüllen. Die heutige Technik ist in der Lage, alle gelösten anorganischen Wasserinhaltsstoffe und auch die meisten organischen Verbindungen sicher aus dem Wasser zu entfernen. Ein großes Problem stellt jedoch häufig die Besiedelung der Oberflächen mit Mikroorganismen dar. Diese gelangen bei der Aufbereitung hauptsächlich durch das Speisewasser in die Anlage, können aber auch durch kontaminierte Anlagenteile oder Lecks eingebracht werden. Allerdings gelangt nur ein sehr kleiner Teil dieser Mikroorganismen in das Pharmawasser. Der größte Teil besiedelt die Oberflächen der Wasseraufbereitungsanlagen als so ...
-
Boehringer-Ingelheim-Preis 2014: 99. und 100. Preisträger ausgezeichnet
Rubrik: Panorama
(Treffer aus TechnoPharm, Nr. 01, Seite 50 (2015))
Boehringer-Ingelheim-Preis 2014: 99. und 100. Preisträger ausgezeichnet / Panorama
Im Rahmen einer feierlichen Preisverleihung zeichnete die Boehringer Ingelheim Stiftung den 99. und 100. Preisträger aus. In diesem Jahr erhielten die Biotechnologin Dr. rer. nat. Ute Distler vom Institut für Immunologie und die Medizinerin PD Dr. med. Julia Weinmann-Menke von der I. Medizinischen Klinik und Poliklinik der Universitätsmedizin Mainz die traditionsreiche Auszeichnung, die mit insgesamt 30 000 Euro dotiert ist. Ute Distler optimierte ein Verfahren zur qualitativen und quantitativen Proteinanalyse, welches die Grundlage ist, um wichtige biologische Prozesse aufzuklären. Julia Weinmann-Menke identifizierte einen neuen Biomarker, der erstmals schon Monate im Voraus eine Prognose über einen bestimmten Krankheitsverlauf bei Patienten mit systemischem ...
Sie sehen Artikel 6221 bis 6230 von insgesamt 11884
- Erste Seite
- 621
- 622
- 623
- 624
- 625
- Letzte Seite