Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11789 Beiträge für Sie gefunden
-
Mikrobiologische Prüfung mittels Konservierungsbelastungstests
Rubrik: Analytik
(Treffer aus pharmind, Nr. 01, Seite 101 (2016))
Mikrobiologische Prüfung mittels Konservierungsbelastungstests / Unterschiede in Durchführung und Bewertung der Prüfung auf ausreichende Konservierung nach DIN (EN), Ph. Eur. und USP * Zusammenfassung des Vortrags im Rahmen der Jubiläumstagung des CPM (Curriculum pharmazeutischer Mikrobiologen), 17.–18. Sept. 2015, Überlingen. · Steinhauer K · Schülke & Mayr GmbH, Norderstedt
Die Sicherstellung der Stabilität eines Produkts gegenüber mikrobieller Kontamination wird für Produkte unterschiedlicher Kategorien wie Arzneimittel, Medizinprodukte und Kosmetika zwingend vorausgesetzt. Zur Überprüfung dieser Stabilität mittels Konservierungsbelastungstests kann auf verschiedene Methoden zurückgegriffen werden, die in ihren Grundzügen ein hohes Maß an Ähnlichkeit aufweisen, jedoch nicht gleich sind. Die Gegenüberstellung von EN 11930, Ph. Eur. 5.1.3. und USP 51 zeigt, dass es in einigen wesentlichen Punkten deutliche Unterschiede zwischen den drei Methoden gibt. Unter Berücksichtigung der hier dargestellten Aspekte kann jedoch ein kombinierter Test im Prüflabor etabliert werden, der die Bewertung eines Produkts nach allen drei Methoden erlaubt.
-
Non-destructive Quality Control of Tablets and Blister Packs by UV Imaging
Rubrik: Originale
(Treffer aus pharmind, Nr. 01, Seite 108 (2016))
Klukkert M | Wu J | Rantanen J | Rehder S | Carstensen J | Rades T | Leopold C
Non-destructive Quality Control of Tablets and Blister Packs by UV Imaging / Klukkert et al. • Quality Control of Tablets and Blister Packs · Klukkert M, Wu J, Rantanen J, Rehder S, Carstensen J, Rades T, Leopold C · 1Division of Pharmaceutical Technology, Department of Chemistry, University of Hamburg, Germany und 2Department of Pharmacy, Faculty of Health and Medical Sciences, University of Copenhagen, Denmark und 3Department of Applied Mathematics and Computer Science, Technical University of Denmark, Denmark und
Multispectral UV imaging multivariate image analysis PCA tablet quality attributes real time quality control blister pack characterization Starting in 2004, the FDA began to motivate pharmaceutical manufacturers to change their drug development paradigm from the traditional approach of measuring the quality of the product to the Quality by Design (QbD) approach, where the quality is built into the product [ 1–3 ]. By setting up a design space where the relationship between input latent parameters from the formulation and the processing to the quality target product profile (QTPP) is established, control of the process can be achieved in real time ...
-
Vorfüllbare Spritzen für die biotechnologischen Anforderungen von Gegenwart und Zukunft
Rubrik: Technik
(Treffer aus pharmind, Nr. 01, Seite 121 (2016))
Vorfüllbare Spritzen für die biotechnologischen Anforderungen von Gegenwart und Zukunft / Zeiß und Petersen • Vorfüllbare Spritzen · Zeiß B, Petersen C · Gerresheimer Bünde GmbH, Bünde
Vorfüllbare Spritzen sind immer noch eines der wachstumsstärksten Segmente im globalen Primärpackmittelmarkt. 2015 wurden weltweit ca. 3 Mrd. vorfüllbare Spritzen verkauft. Vorfüllbare Spritzen müssen unterschiedlichsten Anforderungen genügen, zum einen als möglichst interaktionsarmes Primärpackmittel und zum anderen als sicheres Applikationssystem („Drug Delivery Device“). Besondere Anforderungen an die Reinheit stellen dabei innovative Medikamente aus der biotechnologischen Forschung. Zu den klassischen Einsatzfeldern von Medikamenten in vorfüllbaren Spritzen – Heparine zur Thromboseprophylaxe und Impfstoffe – kommen heute viele weitere Krankheitsbilder hinzu, die mithilfe vorgefüllter Spritzen behandelt werden. Ophthalmologische Anwendungen, Arthritisbehandlung, Wachstumshormone, verschiedene Krebserkrankungen oder Anwendungen bei neurologischen Leiden – jede Therapie erfordert Anpassungen und Weiterentwicklungen, die zunächst ...
-
75 Jahre GRIFOLS
Rubrik: Partner der Industrie
(Treffer aus pharmind, Nr. 01, Seite 131 (2016))
75 Jahre GRIFOLS / pharmind • Partner der Industrie
Grifols, gegründet 1940 in Barcelona, ist ein weltweit agierendes Healthcare-Unternehmen, das im Jahr 2015 sein 75-jähriges Bestehen feierte. Die Firma beschäftigt rund 14 000 Mitarbeiter in 28 Ländern. Grifols gehört zu den Marktführern der Plasmaproteinproduktion. Durch die Übernahme des Novartis-Geschäftsbereichs Diagnose im Jan. 2014 hat das Unternehmen seine Palette in der immunologischen Diagnostik vervollständigt und seine Position als anerkanntes Unternehmen in der Transfusionsmedizin gefestigt. Das Geschäftsmodell basiert auf einem vertikalen Aufbau, der das Unternehmen in die Lage versetzt, den gesamten Produktionszyklus zu steuern, beginnend mit der Gewinnung von Rohmaterial in Form von Plasma durch ein ausgedehntes Netz von Spendezentren in den ... -
Verfahrenstechnik im Aufwind
Rubrik: Editorial
(Treffer aus TechnoPharm, Nr. 02, Seite 59 (2016))
Verfahrenstechnik im Aufwind / Editorial • Verfahrenstechnik im Aufwind
Sehr geehrte Leser des TechnoPharm-Journals, der Markt für Prozessautomatisierung als wesentlicher Teil der Verfahrenstechnik soll in den kommenden 4 Jahren weltweit kontinuierlich um 7 % pro Jahr wachsen – so äußern sich die Analysten von Technavio in ihrer Studie „Global Process Automation and Instrumentation Market 2016–2020“. Die fortlaufende Notwendigkeit zur Reduktion der Produktionskosten ist demnach Motor dieser Entwicklung; Unternehmen können durch weitere Optimierung und effektive Kontrolle ihrer Produktionsprozesse ihre Geschäftsergebnisse verbessern. Unter anderem in der Pharmabranche dominierte besonders das Segment Distributed Control System (DCS) im Jahr 2015 den Markt für Prozessautomatisierung. Die Dezentralisierung durch DCS-Lösungen ermöglicht eine effektive und effiziente Steuerung einer ... -
Mikrodosierung mittels Walzendosiersystem
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 66 (2016))
Mikrodosierung mittels Walzendosiersystem / Vereinfachung der Prozessentwicklung durch geclusterte Vorversuche · Sternberger-Rützel E, Hild M · Harro Höfliger Verpackungsmaschinen GmbH, Allmersbach i.T.
Mikrodosierung Vakuum-Dosierwalze Fließeigenschaften von Pulvern Korrelation Pulvercharakterisitika mit Abfüllparametern Bei der Entwicklung von Formulierungen im Bereich Dry Powder Inhaler (DPI; = Pulverinhalatoren) gibt es 3 verschiedene Varianten. Zunächst existieren sog. Basisvarianten: Zum einen gibt es sog. Interaktive Mischungen [ 1 ], fast immer mit Laktose Monohydrat als Träger. Zweitens sind die „Kontrollierten Agglomerate“ („Softpellets“) zu nennen und drittens zunehmend auch „engineered particles“. Die auf dem Markt befindlichen DPIs sind zu ca. 80 % laktosebasierte Mischungen. Diese enthalten zu einem großen Teil grobkörnige Laktose als Trägermaterial sowie kleine Mengen an mikronisierten Partikeln („fine particles“), bestehend aus sehr kleinen Laktosepartikeln und dem Wirkstoff. ...
-
Right-First-Time durch Embedded Engineering
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 02, Seite 76 (2016))
Right-First-Time durch Embedded Engineering / Ein Schritt auf dem Weg zur effizienten Pharmaproduktion · Garbers P · Endress+Hauser Messtechnik GmbH + Co. KG, Weil am Rhein
Right-First-Time Effizienz Instrumentierung Embedded Engineer Kalibrierung Der Begriff Effizienz wird heute ansatzweise inflationär verwendet. Aber wie kann das hohe Ziel der effizienten Prozessgestaltung mit Hinblick auf Messinstrumentierung und Kalibrierung insbesondere in neuen pharmazeutischen Produktionsanlagen erreicht werden? Eines ist sicher: Ein Wandel in der Zusammenarbeit von Firmen sowie in der firmeninternen Kommunikation ist nötig und bereits im Gange. Die pharmazeutische Welt unterliegt seit ein paar Jahren einem großen Wandel. Wichtig ist hier, zwischen etablierten und neu aufkommenden Märkten (Emerging Markets) zu unterscheiden. Während in etablierten Märkten der Kostendruck steigt, auch getrieben durch Wettbewerb und die nationalen Gesundheitssysteme, haben mehr und mehr ...
-
SPS-Anlagensteuerungen richtig spezifizieren
Rubrik: GMP-Praxis
(Treffer aus TechnoPharm, Nr. 02, Seite 84 (2016))
SPS-Anlagensteuerungen richtig spezifizieren / Röcker • SPS-Anlagensteuerungen · Röcker R · pester pac automation GmbH, Wolfertschwenden
Anlagensteuerung SPS Qualifizierung Risikoanalyse FAT SAT Die Spezifizierungsphase ist eine sehr wichtige Phase im Planungsprozess einer Anlage und deren Steuerung. Sie dient zum Festlegen der Anforderungen an das System. Die einzelnen Schritte müssen im Vorfeld gut durchdacht und hinterfragt werden – denn was hier vergessen wird, kann später hohe Kosten nach sich ziehen. Ausgangspunkt für die Anschaffung einer neuen computergestützten Anlage kann eine Basisrisikoanalyse sein. Sie sollte auf Grundlage der Geschäftsprozesse, der Bewertung der Risiken für das Produkt, der Anforderungen der jeweiligen Anwender und der Regularien durchgeführt werden. Die Basisrisikoanalyse wird von den jeweiligen Experten aus Produktion, Qualitätssicherung, Validierung, Projektleiter ...
-
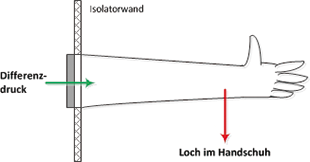
Integritätsprüfung von Isolatorhandschuhen im Sterilbetrieb
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 02, Seite 88 (2016))
Mathe G | Schüller C | Hock S
Integritätsprüfung von Isolatorhandschuhen im Sterilbetrieb / Am Beispiel der Differenzdruckprüfung · Mathe G, Schüller C, Hock S · Boehringer Ingelheim Pharma GmbH & Co. KG
Sterilproduktion Isolator Isolatorhandschuhprüfung Differenzdruckprüfung Evaluierung Ein hohes Risiko für Leckagen in der Isolatorbarriere stellt der Isolatorhandschuh dar. Daher schreiben Good Manufacturing-Practice (GMP)-Leitfäden für die Sterilproduktion wiederkehrende Integritätsprüfungen und Monitorings vor. Um die Systemgrenzen des eingesetzten Prüfsystems, mögliche Einflussfaktoren und die richtigen Prüfparameter für den eingesetzten Handschuhtyp zu finden, geht man streng systematisch vor und bedient sich einfacher Werkzeuge. Trotz der heutigen fortgeschrittenen Automatisierung sind Handschuhe am Isolator nicht aus der Sterilherstellung wegzudenken. Zum Beispiel sind im Inneren des Isolators komplexe Rüstvorgänge und Inprozesskontrollen zu tätigen sowie routinemäßig stattfindende mikrobiologische Bemusterungen durchzuführen und Oberflächen zu bemustern. Auch müssen eventuelle Störungen im Isolator ...
-
GMP risk based environmental control and process monitoring for aseptic processing
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 02, Seite 98 (2016))
GMP risk based environmental control and process monitoring for aseptic processing / Drinkwater • Aseptic processing · Drinkwater J · Franz Ziel GmbH, Billerbeck
risk based environmental monitoring aseptic processing trend metrics Control measures should deliver risk mitigate to acceptable levels, recognising all risks cannot be avoided but can be managed. There are difficulties however setting control measures because new product types – including new biological products – have unique processing challenges ( fig. 1 ) with increasing requirements for cross contamination control, and new technologies for manufacturing and environmental monitoring e. g. single use/disposable systems and Rapid Micro Methods (RMM). Contamination and cross contamination control starts with good process design and today it is better to engineer solutions which do not allow an operator to ...
Sie sehen Artikel 6861 bis 6870 von insgesamt 11789
- Erste Seite
- 685
- 686
- 687
- 688
- 689
- Letzte Seite