Header
Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
Sie suchen in allen Bereichen nach dem Autor Gottlieb O.
In der Rubrik Zeitschriften haben wir 5 Beiträge für Sie gefunden
-
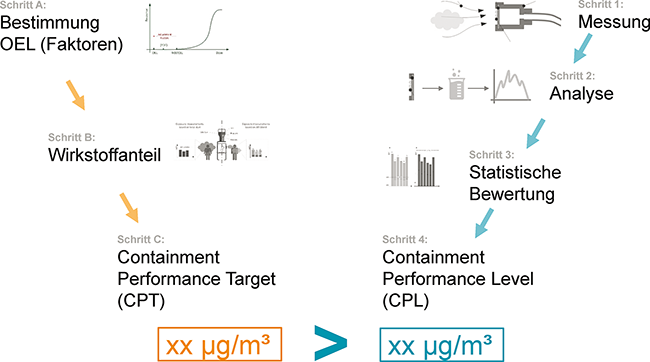
Die Containment-Matrix der ISPE D/A/CH CoP Containment
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 16 (2023))
Schöler M | Nicolai R | Pernau M | Maeck R | Gottlieb O | Hermann F | Maintok M | Denk R | Collins D
Die Containment-Matrix der ISPE D/A/CH CoP Containment / Umgang mit hochaktiven pharmazeutischen Substanzen · Schöler M1, Nicolai R2, Pernau M3, Maeck R4, Gottlieb O5, Hermann F6, Maintok M7, Denk R8, Collins D9 · 1Fette Compacting GmbH, Schwarzenbek 2F. Hoffmann – La Roche AG, Basel 3Bayer AG, Leverkusen 4Boehringer Ingelheim GmbH, Ingelheim 5NNE, Kopenhagen 6Lonza AG, Visp 7Glatt GmbH, Binzen 8Skan AG, Allschwil 9WALDNER Process Systems, Wangen im Allgäu und und
Containment Occupational Exposure Limit (OEL) Arbeitshygiene Rückhalteleistung Hochaktiv SMEPAC Der Schutz von Mitarbeitenden vor dem Kontakt mit gesundheitsgefährdenden Stoffen aus Maschinen und Anlagen durch geeignetes Containment beschäftigt die pharmazeutische Industrie seit vielen Jahrzehnten. Neben der Kenntnis und Nutzung von Containment zum reinen Mitarbeitendenschutz trat in den letzten 10 Jahren v. a. die Notwendigkeit einer übergeordneten Containment-Strategie in den Mittelpunkt, um den Schutz der Patientinnen und Patienten durch die Vermeidung von Kontamination des Produkts und den Schutz der Mitarbeitenden vor Überexposition in Einklang zu bringen. Der erste Leitfaden zum Thema Containment wurde 2005 von der International Society for Pharmaceutical Engineering (ISPE) veröffentlicht [ ...
-
Technologie-Transfer von pharmazeutischen Prozessen
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 05, Seite 270 (2019))
Technologie-Transfer von pharmazeutischen Prozessen / Gottlieb • Technologie-Transfer · Gottlieb O · NNE A/S, Virum (Dänemark)
Technologie-Transfer Pharmazeutische Industrie Launch-Plant-to Large-Scale-Produktion F&E/R&D-to-launch-plant-Produktion In der pharmazeutischen Industrie werden Produkte oft an mehr als nur einem Standort hergestellt, um eine Lieferung an den Kunden zu garantieren. Wird z. B. ein Produkt neu auf den Markt gebracht oder in einer zusätzlichen Produktionsstätte hergestellt, ist eine Übertragung des Produktionsprozesses nötig. Hierbei ist insbesondere darauf zu achten, dass mögliche neue regulative Anforderungen berücksichtigt werden, die etwa erfordern, dass Produkte für den lokalen Markt auch in dem entsprechenden Land oder der Region hergestellt werden müssen. Eine solche Regelung haben u. a. Russland und China. Der Prozess des Überführens eines Produktes oder eines ganzen Produktportfolios ...
-
Upgrade von chemischen API-Anlagen in der Pharmaindustrie
Rubrik: Prozesstechnik
(Treffer aus TechnoPharm, Nr. 01, Seite 14 (2019))
Upgrade von chemischen API-Anlagen in der Pharmaindustrie / Anforderungen an Maschinen und Gebäude · Gottlieb O · NNE A/S, Virum (Dänemark)
Chemischer API Upgrade Containment Hochpotente Wirkstoffe Anlagendesign APIs Für das Upgrade von chemischen Active-Pharmaceutical-Ingredient(API)-Anlagen in der Herstellung pharmazeutischer Wirkstoffe ist es wichtig, dass diese je nach Anforderung an die Herstellungsprozesse, -maschinen, Reinigbarkeit und die umgebenden Gebäude ausgelegt und konzipiert werden, um sowohl die Produktqualität als auch die Patientensicherheit durch Vermeidung von Kontamination und Kreuzkontamination zu gewährleisten. Bestehende Anlagen sind oft sehr alt und werden manuell gefahren. Bestehende Prozesse sind festgelegt, können aber mithilfe von neuen Reaktoren, Automation, Interfaces und neuem Zubehör massiv erleichtert und deren Effektivität und Ausbeute erhöht werden. Trends, Neuerungen und Änderungen sollten beachtet werden, um die Anlageneffizienz ...
-
Es gibt 2 weitere Treffer zu Ihrer Anfrage[ Alle Treffer dieser Rubrik anzeigen ]
In der Rubrik Bücher haben wir 1 Buch für Sie gefunden
-
Good Engineering Practice und Containment-Systeme
Planung und Betrieb von Pharmaproduktionsstätten(Treffer aus Büchern)
Was haben GMP und GEP gemeinsam? In der Pharmaindustrie ist die Good Manufacturing Practice (GMP) jedem ein Begriff. Weniger bekannt ist die Good Engineering Practice (GEP), die sogenannte Gute ...