Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-
LYO-CHECK 2.0
(Treffer aus TechnoPharm, Nr. 02, Seite 70 (2020))
LYO-CHECK 2.0 / Vollautomatische 100%-Inline-Inspektion von pharmazeutischen Lyophilisaten · Kneusels D, Ahrens N · Antares Vision Germany, Friedberg
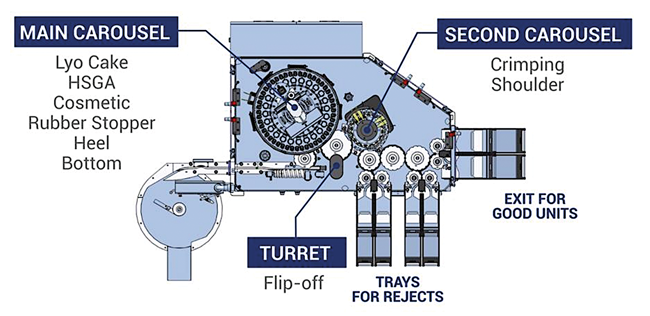
vollautomatische visuelle Kontrolle dynamische Head Space Gas Analysis HSA/HSGA Lyophilisate Antrieb mittels Torque-Motor SIMotion-Steuerung Die Bedeutung von Parenteralia – flüssigen Pharmazeutika, die in der Medizin als Injektionen oder Infusionen eingesetzt werden – nimmt zu. Das liegt u. a. daran, dass immer mehr pharmazeutische Produkte durch biotechnologische Herstellungsverfahren entstehen. Viele flüssige Präparate werden bei der Infektionsbekämpfung eingesetzt, andere zur In-Vitro-Diagnostik. Grundsätzlich besteht für diese z. T. sehr teuren Produkte der Bedarf, deren Haltbarkeit zu erhöhen, ihren Transport sicherer zu machen und die Lagerfähigkeit der abgefüllten Präparate zu verbessern. Sofern es die Spezifikation eines flüssigen Pharmazeutikums zulässt, ist die Gefriertrocknung ein gut geeignetes Verfahren, ...
-
Damit beim Abfüllen nichts klumpt
(Treffer aus TechnoPharm, Nr. 02, Seite 64 (2020))
Damit beim Abfüllen nichts klumpt / Modulares und kompaktes Filtern, Entfeuchten und Konditionieren bei Abfüll- und Verpackungsprozessen in der Pharmaindustrie · Schimmelmann F · ULT Dry-Tec GmbH, Löbau
Prozesslufttrocknung Adsorptionstrocknung Sorptionstrockner Prozessluftentfeuchtung Der weltweite Markt in der Verpackungs- und Abfüllindustrie boomt seit Jahren und gehört zu den umsatzstärksten Segmenten innerhalb des deutschen Anlagen- und Maschinenbaus. Allein im Jahr 2018 lag der deutsche Inlandsumsatz in dieser Branche bei über 19 Mrd. Euro – weltweit bei nahezu 865 Mrd. Euro (Quelle: Statistica/VDMA). Dies verdeutlicht den hohen und wachsenden Bedarf an immer schneller werdenden High-Tech-Verpackungs- oder Abfüllprozessmaschinenlinien in den unterschiedlichsten Bereichen. Dazu gehört auch die Pharmaindustrie inkl. der stark wachsenden weltweiten Bio-Pharmabranche ( Abb. 1 ). Bestimmte Prozesse in der Herstellung und Verarbeitung von Arzneimitteln, etwa anspruchsvolles Verpacken und Abfüllen, bedürfen einer sehr geringen Luftfeuchte. Beim Abfüllen ...
-

„Auch mit 60 kann man noch 40 sein – aber nur noch eine halbe Stunde am Tag.“
Rubrik: Editorial
(Treffer aus TechnoPharm, Nr. 02, Seite 59 (2020))
„Auch mit 60 kann man noch 40 sein – aber nur noch eine halbe Stunde am Tag.“ / Editorial
Sehr geehrte Leserinnen und Leser, das o. g. Zitat belegt, dass Anthony Quinn nicht nur ein berühmter Schauspieler war. Obwohl unsere Gesellschaft immer älter wird und die Senioren gleichzeitig immer fitter bleiben, hinterlässt das Alter eben Spuren, die auch alltägliche Vorgänge unerwartet erschweren. Diesem Umstand sollten laut der Studie „Senior-friendly Healthcare Packaging / A Value Proposition for Universal Packaging” der Association for Packaging and Processing Technologies (PMMI, USA) aus 2019 auch Pharmaverpacker Rechnung tragen. Die Forderung: „Senior-friendly packaging designs, such as sharper text, easier to open closures, clearer instructions, and smart technology should be considered by healthcare packagers as solutions for ... -

OCTUM
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 151 (2020))
OCTUM / pharmind • CPhI 2019
Nicht korrekt verschlossene Vials können zur Kontamination medizinischer Wirkstoffe führen – eine inline-optische Kontrolle ist daher zwingend erforderlich. Der maßgeschneiderte Sensorkopf mit 3 Kameras und Spiegelanordnung ermöglicht eine 360°-Kontrolle. Die Kameraauflösung wird entsprechend Ihrer Fehlerspezifikation und Geometrie festgelegt. Wir liefern Ihnen auch Isolator taugliche Edelstahl Ausführungen. Wir prüfen folgende Fehler: fehlende Kappen und Deckel fehlerhafte Bördelung (Form und Geometrie) Beschädigung der Kappen richtige Farbe von Kappen und Deckel Bedruckungskontrolle auf Bördelkappe und Flip-Offs -

Sanner GmbH
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 151 (2020))
Sanner GmbH / pharmind • CPhI 2019
Modern, kindersicher und einfach im Gebrauch: Der neue TabTec-CR-Tablettenbehälter von Sanner verfügt über einen neuartigen Öffnungsmechanismus, der Kinder vor der versehentlichen Einnahme von Schmerzmitteln, Antidepressiva oder auch medizinischem Cannabis schützt. Der patentierte Press-&-Flip-Verschluss beugt dem Öffnen durch Kinder vor, ist für Erwachsene und v. a. auch für Senioren aber durch Drücken und gleichzeitiges Hochschieben der Verschlusskappe leicht zu handhaben. Das in den Boden integrierte Trockenmittel und die entsprechende Farbwahl schützen den Inhalt jederzeit vor Feuchte. Für eine hygienische und einfache Dosierung der Arzneimittel sorgt die integrierte Schüttöffnung. Die zertifizierte kindersichere Verpackung erfüllt alle regulatorischen Anforderungen (ISO 8317 (2003), PPPA 16 CFR Part 1700, DMF ... -

Müller + Müller
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 151 (2020))
Müller + Müller / pharmind • CPhI 2019
Müller + Müller *) war vom 05.–07. Nov. 2019 auf der wichtigsten Messe der pharmazeutischen Industrie vertreten. Wir nutzten zum wiederholten Male die Gelegenheit, unser Unternehmen und v. a. unsere Primärpackmittel aus Röhrenglas vorzustellen. Unsere Produktpalette umfasst Fläschchen (Vials) von 2–40 ml (Injektions-, Gewinde- und Rollrandflaschen), die standardmäßig im Reinraum nach ISO-Klasse-8-Vorgaben verpackt werden. Mögliche Sonderbehandlung: Ein hochmoderner Innen-Silikonisierungsprozess gewährleistet optimale Ergebnisse bei einem geringen Eintrag an Silikon im Glasfläschchen. Wir möchten uns auf diesem Weg ganz herzlich bei den zahlreichen Kunden und Besuchern aus dem In- und Ausland für ihr Interesse bedanken. -

Faubel & Co. Nachf. GmbH
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 150 (2020))
Faubel & Co. Nachf. GmbH / pharmind • CPhI 2019
Warum Smart-Label flexibel und langlebig sind, zeigte Faubel *) auf der CPhI Worldwide 2019. Ein Beispiel für ein Smart-Label, das analoge und digitale Elemente kombiniert, ist das Faubel-Med® Label. Multinationale klinische Studien benötigen oft eine mehrsprachige Kennzeichnung. Daher setzt sich das Med-Label aus einem seitenstarken Booklet-Etikett, einem E-Paper-Display und einem Radio-Frequency-Identification(RFID)-Tag zusammen. Das Verfallsdatum des Prüfpräparts steht zu Beginn einer Studie nicht immer fest. Verändern sich die Stabilitätsdaten, kann die Anzeige auf dem Display automatisch aktualisiert werden. Smart-Label sind somit flexibel und langlebig. -

FILTROX
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 150 (2020))
FILTROX / pharmind • CPhI 2019
Cannabisöle werden vermehrt in der kosmetischen und pharmazeutischen Industrie eingesetzt. Dies führt dazu, dass die Anforderungen an das Öl selbst immer höher werden. Ein entscheidender Schritt, neben einer optimierten Extraktion, ist die Aufreinigung des Öls nach der Extraktion. Die FILTROX AG bietet hierfür die entsprechenden Filtermedien wie auch das Equipment. In der Regel wird eine 3-stufige Aufreinigung empfohlen. Hierzu werden erst die Grobpartikel mit einem PURAFIX CH 09P Filtermedium entfernt, gefolgt von einer feineren Filtration mit einem PURAFIX CH 31 HP Filtermedium. Die so entstandene Lösung wird dann mit dem Aktivkohlefiltermedium CARBOFIL CA behandelt, um störende Farbpigmente und Chlorophyll zu entfernen. Genauere Informationen hierzu finden ... -

Chemgineering Technology AG
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 150 (2020))
Chemgineering Technology AG / pharmind • CPhI 2019
Für viele Branchen steht das Thema Nachhaltigkeit inzwischen an erster Stelle. Die Pharmabranche macht dabei keine Ausnahme. Denn nachhaltige Pharmaanlagen haben viele positive Aspekte: Gebäude und Prozesse werden auf den schonenden Umgang mit Ressourcen wie Energie und Wasser ausgelegt. Das stärkt nicht nur das „grüne“ Image eines Unternehmens, sondern kann auch Produktionskosten von Anfang an senken. Zudem wächst das Bewusstsein bzgl. der Gesundheit und des Wohlbefindens von Arbeitnehmern am Arbeitsplatz. Inzwischen besteht kein Zweifel mehr daran, dass der Einsatz von ungiftigen Werkstoffen, eine grundsätzlich bessere Luftqualität sowie der intelligente Einsatz von Beleuchtungseinrichtungen auf allen Ebenen Vorteile mit sich bringt. Grund ... -

CPhI 2019
Rubrik: Sonderteil CPhI 2019
(Treffer aus pharmind, Nr. 01, Seite 149 (2020))
CPhI 2019 / pharmind • CPhI 2019
In eigener Sache An der CPhI worldwide nahmen im Nov. 2019 etwa 49 000 Besucher in Frankfurt/Main teil. Die Messe beherbergt 6 Subevents, die zusammen die komplette Bandbreite der pharmazeutischen Lieferkette abbilden. Das reicht von API´s über den Maschinen- und Anlagenbau bis hin zu Biopharmazeutika und Outsourcing. Bei der 30. Auflage der Leitmesse in Europa organisierte der Editio Cantor Verlag (ECV) erstmals den Gemeinschaftsstand <Excellence in Pharma> ( Abb. 1 ) in der InnoPack-Halle 11.1. Auf diesem stellten die folgenden 9 Mitaussteller ihre Produkte und Dienstleistungen für die Pharmaindustrie vor: chemgineering (GMP Engineering und Beratung) faubel Pharma Services (Labeling) Filtrox (Tiefenfiltration ...
Sie sehen Artikel 2831 bis 2840 von insgesamt 11970
- Erste Seite
- 282
- 283
- 284
- 285
- 286
- Letzte Seite