Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11911 Beiträge für Sie gefunden
-
6-Achs-Robotersystem für die aseptische Produktion
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 6 (2018))
Keller M | Baum G | Brückner M | Ringe U | Schweizer M | Berthold L | Bürger F | Gommel U
6-Achs-Robotersystem für die aseptische Produktion / Ganzheitlicher Ansatz einer Eignungsqualifizierung – Teil 1 · Keller M, Baum G, Brückner M, Ringe U, Schweizer M, Berthold L, Bürger F, Gommel U · Fraunhofer-Institut für Produktionstechnik und Automatisierung IPA, Stuttgart und und
Reinraumtauglichkeit Partikelemission GMP Hygienic Design Reinigbarkeit Maschine Für eine Vielzahl hygienischer Produktionsszenarien sind die Anforderungen hinsichtlich Kontaminationen extrem hoch. Vor allem in der Herstellung steriler Arzneiprodukte ist es unerlässlich, dass Anlagen und Geräte das Produkt weder mit Partikeln noch mit Mikroorganismen verunreinigen. Um dies zu ermöglichen, werden Anlagen und Geräte in regelmäßigen Abständen desinfiziert und gereinigt. Eine Anlage kann nur effektiv dekontaminiert werden, wenn alle Flächen durch Reinigungs- und Desinfektionsprozesse erreicht werden können. Dafür müssen das Anlagengehäuse und alle betriebenen Komponenten und Schnittstellen entsprechend hygienisch gestaltet werden. Die verwendeten Chemikalien dürfen die verbauten Materialien nicht korrodieren. Eine Ansammlung von Partikeln ...
-
Arzneimittelforschung und Gesundheit: Bilanz 2017 und Ausblick 2018
Rubrik: Statements der Verbände
(Treffer aus pharmind, Nr. 01, Seite 7 (2018))
Arzneimittelforschung und Gesundheit: Bilanz 2017 und Ausblick 2018 / pharmind • Statements der Verbände · Fischer B · Hauptgeschäftsführerin des vfa – Die forschenden Pharmaunternehmen
Die Behandlungsmöglichkeiten für Patienten mit unterschiedlichsten Krankheiten konnten forschende Pharma-Unternehmen 2017 weiter verbessern. Insbesondere haben sie die Therapieoptionen durch das Arzneimittelsortiment mit 31 Medikamenten mit neuem Wirkstoff erweitert (ohne Biosimilars). Mit den neuen Medikamenten kann vielen Patienten besser geholfen werden. Für einige Patienten hat die Pharmaforschung sogar erstmals eine Behandlungsmöglichkeit geschaffen. Gut ein Drittel der Medikamente mit neuem Wirkstoff (11) helfen bei verschiedenen Krebserkrankungen, weitere 10 Medikamente wirken erfolgreich bei Entzündungskrankheiten. Die sich fortsetzenden Erfolge in der Onkologie bringen Patienten wichtige Fortschritte. Für Patienten und Ärzte ist es wichtig, dass in der Krebstherapie unterschiedliche Therapieprinzipien verfügbar sind – sei es in ...
-
Einführung eines Referenzpreissystems bei Medikamenten
Rubrik: Statements der Verbände
(Treffer aus pharmind, Nr. 01, Seite 9 (2018))
Einführung eines Referenzpreissystems bei Medikamenten / Führende Vertreter des schweizerischen Gesundheitssystems opponieren geschlossen · Müller A · Geschäftsführer des schweizerischen Verbands Intergenerika
In der vermeintlich beschaulichen Schweiz geht es seit geraumer Zeit hoch her in der Diskussion um die besten Mittel zur Bekämpfung der steigenden Gesundheitskosten. Eine zentrale Forderung der Krankenkassen und dem sogenannten Preisüberwacher – eine antiquierte Institution, die auf methodisch falscher Basis Jahr für Jahr Preise von Schweizer Medikamenten mit denen im Ausland vergleicht – ist die Einführung eines Referenzpreissystems bei Medikamenten. In seinem kürzlich erschienenen Newsletter erhöhte der Preisüberwacher den Druck auf die politischen Entscheider weiter und forderte dazu auf, die Medikamente im Ausland zu kaufen, welche die Schweizer Krankenkassen dann zu vergüten hätten. Dies ist aus zweierlei Sicht ...
-
Mit Kooperation und Dialog die Innovation im Gesundheitssektor stärken
Rubrik: Statements der Verbände
(Treffer aus pharmind, Nr. 01, Seite 11 (2018))
Mit Kooperation und Dialog die Innovation im Gesundheitssektor stärken / pharmind • Statements der Verbände · Buholzer R · Generalsekretär Interpharma iph
Innovation ist der Treiber des medizinischen Fortschritts und der Volkswirtschaft. Neue und wirksame Medikamente verbessern die Lebensqualität von Patienten und tragen maßgeblich dazu bei, dass wir heute nicht nur immer älter werden, sondern v. a. viele zusätzliche Jahre bei guter Gesundheit verbringen dürfen. Innovation ist aber auch der Schlüssel zu wirtschaftlichem Erfolg und Wohlstand, gerade in einem Land wie der Schweiz, dass über keine natürlichen Rohstoffe verfügt. Die Medizin macht zurzeit große Fortschritte – und das ist gut so. Hepatitis C ist in 95 % der Fälle heilbar geworden. Aids ist von einer tödlichen zu einer kontrollierbaren Krankheit geworden. Bei Krebserkrankungen – in der Schweiz ...
-
Kalte WFI-Herstellung
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 12 (2018))
Kalte WFI-Herstellung / Teil 1: Rahmenbedingungen und Vorgehensweise im Projekt · Rücker T, Cole M · Letzner Pharmawasseraufbereitung GmbH, Hückeswagen
M-WFI Annex 15 mikrobiologisches Monitoring Ultrafiltration Hygienic Design Eine aus kalt erzeugtem Water for Injection (WFI) hergestellte Infusionslösung – ist das vorstellbar? Ist es vorstellbar, zuverlässige, robuste und bewährte Technologie wie die Destillation durch alternative Verfahren zu ersetzen – basierend auf einer Risikobewertung oder Erfahrung? Diese spannende Herausforderung bringt die Änderung der europäischen Monografie mit sich, gemäß derer die Erzeugung von WFI nicht mehr länger ausschließlich per Destillation erlaubt ist. Explizit wird bei der Benennung alternativer Methoden hierbei die Umkehrosmose-Technologie als zentrale Aufbereitungsstufe benannt. Diese soll mit weiteren Verfahrensschritten wie der Elektro-Deionisation (EDI) und der Ultrafiltration (UF) zu einem Herstellungsprozess ...
-
Der Wirtschaft Chancen lassen
Rubrik: Statements der Verbände
(Treffer aus pharmind, Nr. 01, Seite 13 (2018))
Der Wirtschaft Chancen lassen / pharmind • Statements der Verbände · Huber J · Generalsekretär der Pharmig – Verband der pharmazeutischen Industrie Österreichs
Davon zu sprechen, dass ein ereignisreiches Jahr zu Ende ginge, wäre nur die halbe Wahrheit. Denn aufgrund der neuen Regierungskonstellation in Österreich ziehen sich die Ereignisse über den Jahreswechsel ungehindert fort. Daher: Ereignisreich ist und war nicht nur das vergangene Jahr, sondern ereignisreich ist schlichtweg die Zeit. Mit jedem Neubeginn sind immer auch große Erwartungen verbunden. So auch in unserem Fall: Wir setzen Erwartungen in die neue Regierung, dass sie die Wirtschaft und die Industrie stärken möge. Gerade unsere Branche hat in den vergangenen Jahren mit zunehmend schwieriger werdenden Rahmenbedingungen zu kämpfen. Arzneimittelpreise stehen global in der Kritik, wobei der Blick ...
-
Herstellung von Generika vor Patentablauf?
Rubrik: Streiflichter
(Treffer aus pharmind, Nr. 01, Seite 16 (2018))
Herstellung von Generika vor Patentablauf? / Bedeutung für den Produktionsstandort Deutschland und Europa · Sträter B · Sträter Rechtsanwälte, Bonn
Das Europäische Parlament hat im Jahre 2016 die Europäische Kommission aufgefordert zu überprüfen, ob das System des Patentrechts und der Schutzzertifikate einer grundlegenden Änderung oder Anpassung an neue Entwicklungen bedarf. Die Europäische Kommission hat dazu am 15.02.2017 eine Folgenabschätzung veröffentlicht und u. a. die Frage aufgeworfen, ob die sog. „Bolar-Ausnahmen“ nicht nur für die Entwicklung, sondern auch für die Herstellung von Generika gelten sollen. Am 12.10.2017 hat die Europäische Kommission eine öffentliche Konsultation initiiert. Die Frist zur Stellungnahme für die Fachkreise endete am 04.01.2018. Nach Ausfertigung ist also im Jahre 2018 mit einer Gesetzesinitiative zu rechnen. Die Diskussion zur Ausnahme von ...
-
Gut gerüstet – nicht nur für das Reich der Mitte
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 18 (2018))
Gut gerüstet – nicht nur für das Reich der Mitte / Kartons aggregieren – übereck etikettieren · Kürten-Kreibohm S · Bluhm Systeme GmbH, Rheinbreitbach
Case Labeling Kartonkennzeichnung Aggregation Übereck-Etikettierung China-Code Serialisierung Aufgrund internationaler Vorgaben, aber auch aus praktischen Gründen suchen Pharmaunternehmen wie auch Maschinenbauer zunehmend nach Lösungen, wie sie automatisch auf 2 Seiten eines Produktes Etiketten aufbringen können. Eine Möglichkeit ist, 2 angrenzende Karton-Seiten mit jeweils einem separaten Etikett zu versehen. Besser wäre jedoch eine Übereck-Etikettierung, denn sie bietet einige Vorteile gegenüber der Variante mit 2 Etiketten. Die Anwendung selbst – Kartons übereck etikettieren – stellt dabei schon hohe Anforderungen an die Technik. Aber auch Pharmaunternehmen und insbesondere Maschinenbauer haben bestimmte Vorstellungen, was ein Etikettierer alles leisten sollte. Welche Anforderungen muss die Etikettiertechnik also erfüllen, und was ...
-
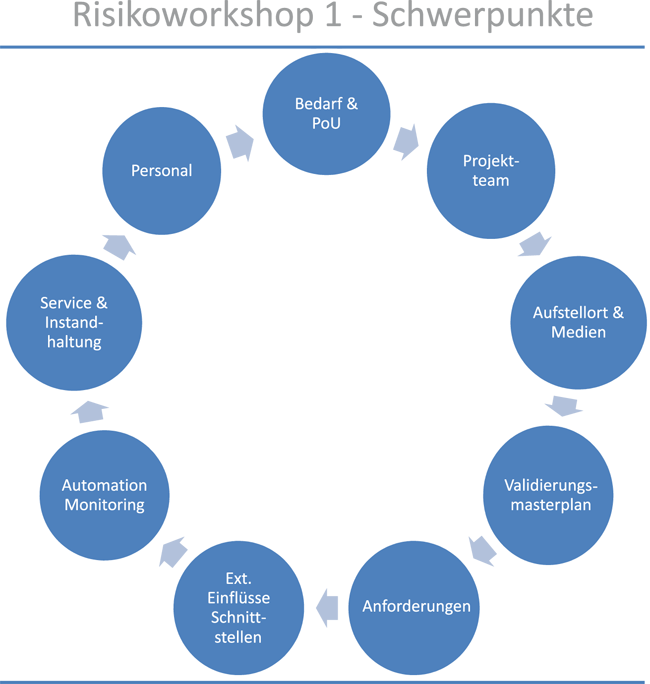
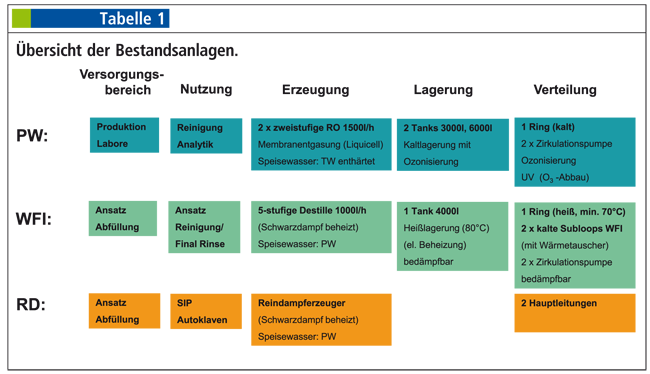
Modernisierung der Reinmedienversorgung
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 22 (2018))
Modernisierung der Reinmedienversorgung / Teil 1 · Wiechmann K, Schreitter M · Advance Pharma GmbH, Berlin, Seit August 2016 ist Kai Wiechmann als Technischer Leiter der Advance Pharma in Berlin tätig.
Reinmedienversorgung Purified Water Water for Injections Umbau im Bestand Der Umbau der Reinmedienversorgung kann einen Standort bis ins Mark treffen. Wie kaum bei einem anderen Projekt wird die weitreichende Abhängigkeit von Reindampf (RD), Water For Injection (WFI) oder Purified Water (PW) deutlich, die für Reinigung und Sterilisation oder den Ansatz der Produkte selbst benötigt werden. Die Bereitschaft, in diese wichtigen Systeme zu investieren, ist hoch; jedoch ist die Akzeptanz von längeren Versorgungslücken gering. Daher gilt es diese Unterbrechungen kurz zu halten und umgebaute bzw. neue Systeme schnell für eine Nutzung verfügbar zu machen. Sich dieser Herausforderung stets bewusst, beschloss Bausch ...
-
LUSH PRIZE 2017 zur Förderung tierversuchsfreier Testmethoden
Rubrik: In Wort und Bild
(Treffer aus pharmind, Nr. 01, Seite 24 (2018))
LUSH PRIZE 2017 zur Förderung tierversuchsfreier Testmethoden / pharmind • In Wort und Bild
Miniaturisierte Organe auf einem Chip ermöglichen, Arzneimittel vor der Anwendung am Menschen zu testen. Am Karlsruher Institut für Technologie (KIT) hat die Forschungsgruppe von Prof. Ute Schepers ein solches Organ-on-a-Chip-System mit naturgetreu nachgebildeten Blutgefäßen entwickelt. Die Doktorandin Vanessa Kappings, die an der Weiterentwicklung des „vasQchip“ beteiligt und auf dem Gebiet des Tissue Engineering tätig ist, hat nun den LUSH PRIZE 2017 zur Förderung tierversuchsfreier Testmethoden in der Kategorie „Nachwuchsforscher“ gewonnen und erhält 12 000 Euro für ihr Projekt. Auf dem „vasQchip“ gelangen die zu testenden Wirkstoffe über die künstlichen Blutbahnen in die miniaturisierten Organe. Deren Reaktion lässt sich automatisiert auswerten. So lassen sich ...
Sie sehen Artikel 8011 bis 8020 von insgesamt 11911
- Erste Seite
- 800
- 801
- 802
- 803
- 804
- Letzte Seite