Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Querbahnetikettierer
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 62 (2024))
Querbahnetikettierer / Produkte
Die Firma MULTIVAC *) hat die neue Querbahnetikettierer-Modellreihe CL 1 vorgestellt. Die Modelle sind für Tiefziehverpackungsmaschinen geeignet und können sowohl in neue Maschinen integriert als auch auf bestehenden Maschinen nachgerüstet werden. Der modulare Aufbau ermöglicht eine individuelle Anpassung an Kundenwünsche. Nach Herstellerangaben ist die neue Modellreihe schnell etikettierbereit und für einen zügigen Chargenwechsel ausgelegt. Die neuen Modelle können Etiketten bis zu einer Breite von 150 mm präzise und produktschonend auf die Ober- und Unterseite aller Arten von Packungen aufbringen. Die präzise einstellbare Etikettenführung benötigt weniger Umlenkrollen. Eine Aufwickelrolle mit Kunststoffgliederkette sorgt für ein schnelles und einfaches Abziehen des aufgewickelten Trägermaterials, die ... -
Einzelzellanalyse
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 62 (2024))
Einzelzellanalyse / Produkte
Die Firma LPKF *) hat die Plattform CellShepherd®, die von der ARRALYZE®-Gruppe entwickelt wurde, um kleine und große Zellpopulationen auf Einzelzellebene zu untersuchen und Zielzellen zu isolieren, auf den Markt gebracht. Sie verfügt über ARRALYZE-eigene Nanowell-Glasarrays, die in Nanoliter-Glasvertiefungen eine präzise Dosierung erlauben und die zellbasierte Proben miniaturisieren und gleichzeitig eine Echtzeitüberwachung auf Einzelzellebene ermöglichen. Zudem unterstützt sie die (Ko)-Kultivierung unter klimakontrollierten, sterilen Bedingungen. Weiter Vorteile sind nach Herstellerangaben: erweiterte Echtzeit-Bildgebungsfunktionen, einschließlich eines Hellfeldmikroskops und 3 Fluoreszenzkanälen KI-gesteuerte Analysen, die eine genaue Zellzählung und -verfolgung ermöglichen und so wichtige Einblicke in verschiedene Parameter bieten benutzerfreundliche Oberfläche Möglichkeit, lebende Zellen für ... -
Aktivitäten des PDCO
Rubrik: europharm
(Treffer aus pharmind, Nr. 01, Seite 62 (2024))
Aktivitäten des PDCO / Throm • PDCO · Throm S · Berlin
Bei seiner Sitzung vom 10.–13. Okt. 2023 dankte der Ausschuss für Kinderarzneimittel (PDCO) dem ausscheidenden stellvertretenden Mitglied Vessela Boudinova/Bulgarien und begrüßte Agnes Gyurasics als neues stellvertretendes Mitglied für Österreich. Die Europäische Kommission hat für die Patientenorganisationen Eric Vermeulen und als dessen Stellvertreterin Victoria Romero Pazos berufen. Der Ausschuss verabschiedete bei dieser Sitzung folgende Empfehlungen: 10 Voten zu pädiatrischen Prüfkonzepten (PIP) für folgende in Entwicklung befindliche Medikamente: Amlitelimab zur Behandlung der atopischen Dermatitis ab 6 Monaten; Sanofi Winthrop Upadacitinib zur Behandlung der Hidradenitis suppurativa ab 12 Jahren; AbbVie Upadacitinib zur Behandlung des systemischen Lupus erythematodes ab 5 Jahren; AbbVie Venglustat zur Behandlung von Morbus ...
-
Vial-Inspektionsgeräte
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 61 (2024))
Vial-Inspektionsgeräte / Produkte
Der HEUFT InLine II IS von HEUFT *) untersucht alle Vials schon vor dem Befüllen lückenlos. Injektionsfläschchen, die z. B. durch Glasbruch im Heißsterilisationstunnel mit kleinsten Glassplittern verunreinigt sind, werden erkannt und sicher ausgeleitet, bevor das Produkt hineinkommt. Zusätzlich zur lückenlosen optischen Bodeninspektion mit Hochleistungskameras und adaptiver, homogener Ausleuchtung, die sogar transparente und reflektierende Fremdstoffe und Defekte sichtbar macht, untersucht der Leerbehälterinspektor der neuen Generation auch die Seitenwände und den Mündungsbereich vollabdeckend und ohne blinde Flecken. Mittels Servotechnologie werden die einzelnen Vials dazu gezielt gedreht und an jeder einzelnen Erkennungsstation genau richtig ausgerichtet. Mit benutzerbezogenen Zugriffsrechten und einem detaillierten Audit-Trail-Protokoll ... -
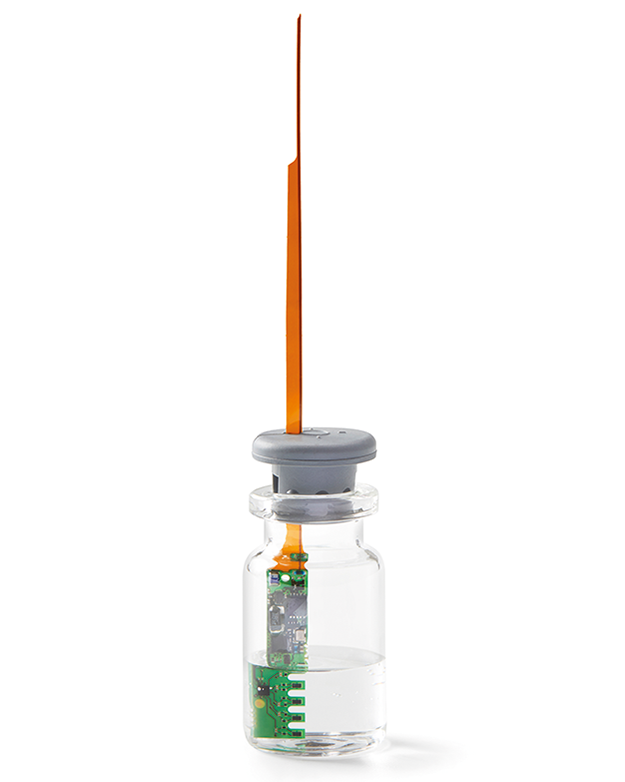
PAT Monitoring Tools
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 61 (2024))
PAT Monitoring Tools / Produkte
Developed by Telstar *) , Sublime is a new PAT tool capable of accurately monitoring the advance of the sublimation front in real time in GMP freeze-drying processes. The new probe offers 5 measuring points integrated in each probe which, placed within the vial, allows to monitor the temperature of each level of the product in real time. Sublime probes are coated with an FDA approved material and are available to fit in most common vial sizes. Without cables or batteries, the probes work with a patented wireless power transmission technology and are designed as a single-use devices. After using them ... -
Automated sample prep for chromatography
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 61 (2024))
Automated sample prep for chromatography / Produkte
Tecan *) has announced the launch of Resolvex Prep, a mid-range, benchtop automation solution for chromatography sample prep. The instrument is purpose-built for chromatography workflows, and it is especially suitable for LC-MS sample prep. It can handle a range of batch sizes (from five to 100 samples), making it an ideal solution for medium-throughput labs. It is designed to enhance the efficiency, accuracy and reliability of chromatography sample prep. Resolvex Prep overcomes several challenges associated with chromatography sample prep by using direct displacement pipetting to avoid the hazards associated with volatile solvents and accommodating sealed sample tubes to prevent ... -
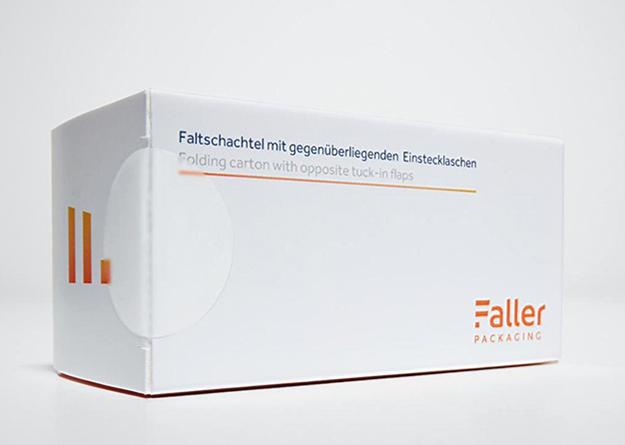
Papier-Verschlussetiketten
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 60 (2024))
Papier-Verschlussetiketten / Produkte
Ein neues Papier-Verschlussetikett wird von Faller Packaging *) angeboten. Das Obermaterial des Etiketts besteht aus halbtransparentem Papier, aus reiner Zellulosefaser und ohne Chemikalienzusätze. Dadurch ist es biologisch abbaubar und kann recycelt werden. In Kombination mit einer faserbasierten Faltschachtel oder einer Outsert-Packungsbeilage entsteht so ein sortenreines Endprodukt, welches ohne Sortierung dem Recyclingprozess zugeführt werden kann. Das Etikett bietet einen Erstöffnungsschutz und erfüllt so die EU-weit verbindliche Norm EN 16679:2014. Es wird von Faller über der Einstecklasche der Faltschachtel positioniert. Auf diese Weise lassen sich Manipulationen an der Verpackung verhindern. Wurde die Schachtel bereits geöffnet, ist das deutlich sichtbar. Weitere Vorteile ... -
Dichtheitsprüfgeräte
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 60 (2024))
Dichtheitsprüfgeräte / Produkte
Pfeiffer Vacuum *) bringt mit dem neuen Dichtheitsprüfgerät SpeedAir3050 eine Komplettlösung für die Prüfung nicht poröser Behälter in der Pharmaindustrie auf den Markt. Der SpeedAir bietet eine CCIT-Lösung für eine Vielzahl von Produkten: Das Dichtheitsprüfgerät kann alle flexiblen und starren Behälter sowie flüssige und feste Produkte schnell und präzise prüfen. In nur 30–45 Sekunden liefert der SpeedAir schnell und effizient Ergebnisse. So wird die Dichtheit von Behältern für pharmazeutische Produkte sichergestellt. Im Gegensatz zu alternativen Verfahren, die sich auf einzelne Bereiche oder Zugangspunkte konzentrieren, bietet der SpeedAir einen ganzheitlichen Ansatz für die zerstörungsfreie Prüfung von Behältern. Das Verfahren entspricht der ... -
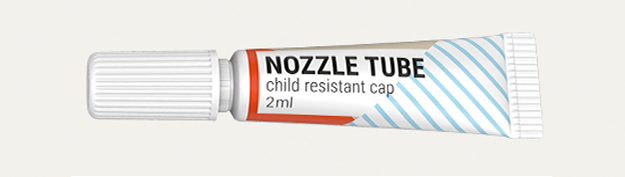
Pharmatuben
Rubrik: Produkte
(Treffer aus Tech4Pharma, Nr. 01, Seite 60 (2024))
Pharmatuben / Produkte
Die 10-mm-CR-Tube von Neopac *) ist die bisher kleinste kindersichere Tube auf dem Markt und bietet beispielhafte Sicherheit und unvergleichlichen Komfort für den Verbraucher. Die Tuben sind mit einem Durchmesser von 10 mm und einem Fassungsvermögen von 0,5–2 ml erhältlich. Sie bestehen aus zertifizierten Materialien in Pharmaziequalität und sind für Flüssigkeiten und Cremes geeignet. Die CR-Tuben werden unter ISO 8-Reinraumbedingungen in Neopac-Einrichtungen in Europa und den USA hergestellt und bieten einen hohen Barriereschutz für empfindliche, toxische oder konzentrierte Rezepturen. Sie können für eine überzeugende Ästhetik durch Direktdruck dekoriert werden. -
Aktivitäten des COMP
Rubrik: europharm
(Treffer aus pharmind, Nr. 01, Seite 60 (2024))
Aktivitäten des COMP / Throm • COMP · Throm S · Berlin
Der Ausschuss für Arzneimittel gegen seltene Krankheiten (Committee for Orphan Medicinal Products, COMP) verabschiedete bei seiner Sitzung vom 3.–5. Okt. 2023 bei der europäischen Arzneimittelagentur EMA in Amsterdam folgende Voten: 11 Empfehlungen für die Zuerkennung des Orphan-Status für die folgenden in Entwicklung befindlichen Medikamente: Oregovomab zur Behandlung von Eierstock-Karzinomen; IQVIA RDS Setanaxib zur Behandlung des Alport-Syndroms; Calliditas Therapeutics Rucosopasem Mangan zur Behandlung von Pankreaskarzinomen; Agos Healthcare 5-Brom-N-(prop-2-yn-1-yl)-2-(1H-1,2,4-triazol-1-yl)pyrimidin-4,6-diamin zur Behandlung des Prader-Willi-Syndroms; Palo Biofarma N-{(2S,3R)-4,4-Difluor-1-(2-hydroxy-2-methylpropanoyl)-2-[(2,3',5'-trifluor[1,1'-biphenyl]-3-yl)methyl]pyrrolidin-3-yl}ethansulfonamid zur Behandlung der Narkolepsie; Takeda Pharma Ambroxolhydrochlorid zur Behandlung von Morbus Gaucher; CATS Consultants Riboflavin zur Behandlung des Mangels an mittelkettiger Acyl-Coenzym-A-Dehydrogenase; Iniuva humanisierter Immunglobulin-G1-monoklonaler Antikörper ...
Sie sehen Artikel 831 bis 840 von insgesamt 11884
- Erste Seite
- 82
- 83
- 84
- 85
- 86
- Letzte Seite