Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-

HPLC-Systeme
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 03, Seite 180 (2020))
HPLC-Systeme / Produkte
Shimadzu *) hat die neue Nexera Prep Series für die präparative Hochleistungsflüssigkeitschromatografie (HPLC) eingeführt. Die Serie vereint mehrere Module zu einem präparativen HPLC-System. Um die Anlage den Kundenwünschen anzupassen, können verschiedene Pumpen, Probengeber und Detektoren verwendet werden. Die Konfiguration wird durch die Wahl des LH-40 Liquid Handler oder FRC-40 Fraktionssammler, eines Säulenschranks und einer Shim-pack-Scepter-Säule für analytische und präparative Arbeiten komplettiert. Die neue softwarebasierte Fraktionierungssimulation verkürzt die Zeit für die Methodenerstellung. Der Methodentransfer von analytischer zu präparativer Trennung ist durch das System deutlich einfacher. Es werden hierfür identische Säulenmaterialien für analytische Methodenentwicklung sowie für die präparative Anwendung angeboten. -

Differenzdruckmessumformer
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 03, Seite 180 (2020))
Differenzdruckmessumformer / Produkte
Labom *) hat mit dem digitalen Differenzdruckmessumformer PASCAL CV4 Delta P CV 4300 einen kompakten und flexiblen Druckmessumformer entwickelt, der sich auch unter beengten Platzverhältnissen einbauen und bedienen lässt. Das Edelstahlgehäuse ist mit einer Schutzart von International Protection (IP) 65 oder 67 (optional IP 69K) ausgestattet und der elektrische Anschluss ist stufenlos um 170° gegenüber dem Prozessanschluss drehbar. Dank der hohen Prozessorleistung läuft die Steuerung besonders flüssig; auch die intuitive 4-Tasten-Bedienerführung und die frei konfigurierbaren Anzeigemodi tragen zur Benutzerfreundlichkeit bei. Das Display ist auch unter Spannung abnehmbar. Der Nennbereich liegt zwischen 0,25 bar und 40 bar bei einer Genauigkeit von 0,15 %. Das Ausgangssignal liegt bei ... -

Mehrkopfwaagen
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 03, Seite 179 (2020))
Mehrkopfwaagen / Produkte
Ishida *) bietet für Abfüllung und Verpackung von medizinischem Cannabis die Mehrkopfwaage CCW-RV-214-05 für Zielgewichte von 3–50 g an. Die Waage schafft Geschwindigkeiten von bis zu 100 Takten pro Minute. Ihre einzigartige Genauigkeit ermöglicht eine von Ishida neuentwickelte Wiegezelle mit Wiegeschrittweiten von lediglich 0,025 g. Die Mehrkopfwaage CCW-RV-214-05 verarbeitet Cannabisblütenstücke ab einer Größe von 1 mm. Das Schalenvolumen wurde so bestimmt, dass das gewünschte Zielgewicht mit einem einzigen Abwurf erreichbar ist. Für noch mehr Wiegeeffizienz sorgen elektropolierte Kontaktflächen aus Edelstahl 316, die Produktablagerungen minimieren. Die Mehrkopfwaage integriert viele fortschrittliche Funktionen der Ishida-Serie CCW-RV. Dazu zählt die Pulsweitenmodulation zur automatischen Regulierung des Verteiltellers und der ... -

PAT-Komponenten
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 03, Seite 179 (2020))
PAT-Komponenten / Produkte
Mit den SCHOTT *) ViewPort TM Prozessanalysetechnologie(PAT)-Komponenten ist eine kontinuierliche In-situ-Messung möglich, ohne die Bioreaktorgrenze zu durchdringen. Die patentierte Sensor- bzw. Spektrometeraufnahme verfügt über ein optisches Fenster aus Saphir, das eine Prozessüberwachung in Echtzeit ermöglicht. Die Komponenten sind als Standardvarianten für Mehrweg-Bioreaktoren (MUB) sowie als spezielle Ausführung für Einweg-Bioreaktoren (SUB) erhältlich. SCHOTT ViewPort TM eignet sich für Bioreaktoren unterschiedlicher Größe und verfügt über einen Standard-Portdurchmesser und eine Standard-Flanschgröße zur einfachen Integration in bestehende Systeme und Designs. Eine sichere Verbindung mit Ingold-, Standard- sowie individuell angepassten Anschlüssen von Bioreaktoren ermöglicht zudem einen einfachen Sterilisationsprozess, z. B. Steam-in-Place (SIP) des Bioreaktors samt ... -

Adsorptionstrockner
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 03, Seite 179 (2020))
Adsorptionstrockner / Produkte
Die ULT AG *) hat die Effizienz ihrer bewährten Baureihe zur Adsorptionstrocknung ULT-Dry-Tec® 7.2 arid gesteigert und senkt damit die Betriebskosten für Anwender. Konkret handelt es sich um die direkte Einsparung an Wärmeleistung bis zu 35 % gegenüber dem Energiebedarf ohne zusätzliche Wärmerückgewinnung. Dank eines neuen Konzepts zur Energierückgewinnung durch einen integrierten Wärmeübertrager kann eine wesentliche Verringerung des Energiebedarfs für die Lufttrocknung erzielt werden. Dieser Wärmeübertrager hat nun einen Wirkungsgrad von bis zu 80 % und fügt sich in die bestehende Gehäusestruktur ein, ohne auf zusätzliche externe Anlagenelemente zurückzugreifen. Die Wärme wird dabei aus dem Abluftstrom und einem Teil der darin enthaltenen und ... -

100 Jahre Fritsch
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 03, Seite 178 (2020))
100 Jahre Fritsch / Spektrum
Nach knapp 40 Jahren als Geschäftsführer der Fritsch GmbH verabschiedete sich Robert Fritsch zum 01.01.2020 in den langfristig geplanten Ruhestand. Er blickt zurück auf Zeiten der Modernisierung, des Wachstums und des Erfolgs. Das mittelständische Familienunternehmen wurde 1920 als technische Edelsteinhandlung von Max und Alfred Fritsch in Idar-Oberstein gegründet. Nach dem zweiten Weltkrieg übernahmen Willi und Paul Fritsch, die Söhne von Alfred Fritsch, die Geschäftsleitung. Als 2. Generation des Unternehmens suchten sie nach einer neuen Geschäftsidee, denn im Anwendungsgebiet von Fritsch hielten immer mehr synthetische Materialien Einzug. Schon bald stand fest, sich zukünftig auf den Nischenmarkt anwendungsorientierter Laborgeräte für die Probenaufbereitung ... -

50 Jahre Drees & Sommer
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 03, Seite 177 (2020))
50 Jahre Drees & Sommer / Spektrum
Ein Laborgebäude der Bayer AG bei laufendem Betrieb umbauen, Labormitarbeitern der analytischen Entwicklung und Forschung bei der Wala Heilmittel GmbH die Arbeit in einem nach höchsten Nachhaltigkeitsstandards errichteten Gebäude ermöglichen oder die Planung einer zentralen Produktionsstätte zur Verarbeitung von Blutplasma für die Biotest AG umsetzen – Projekte im Bereich Life Sciences gelten beim internationalen Beratungsunternehmen Drees & Sommer als besonders anspruchsvoll. Als Gerhard Drees und Hans Sommer 1970 in Stuttgart ein kleines Ingenieurbüro mit anfangs 3 Mitarbeitern gründeten, konnten sie nicht ahnen, zu welcher Größe und Bedeutung das heutige Beratungs-, Planungs- und Projektmanagement-Unternehmen Drees & Sommer eines Tages in der Bau- und Immobilienbranche heranwachsen würde. 50 Jahre ... -

2-komponentige Fluide und Pasten kontinuierlich mischen und abfüllen
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 03, Seite 176 (2020))
2-komponentige Fluide und Pasten kontinuierlich mischen und abfüllen / Spektrum
ViscoTecs neues Dosiersystem ViscoDUO-VM HD ( Abb. 1 ) bietet kontinuierliches Mischen und Dosieren von 2 niedrig- bis hochviskosen Materialien mit gleichen oder unterschiedlichen Viskositäten und garantiert eine präzise, wiederholgenaue und prozesssichere Durchmischung in einem validierten Prozess. Alle Komponenten des neuen ViscoDUO-VM HD erfüllen die GMP-Forderungen und sind FDA-konform. Der modulare Aufbau des ViscoDUO-VM HD mit beidseitig 4 verschiedenen Größen ermöglicht den Einsatz in den verschiedensten Anwendungen. Durchflussraten von 0,5 ml/min bis über 1 000 ml/min können umgesetzt werden. Der Dispenser ist einfach in automatisierte Prozesse zu integrieren. Dank dem verbauten Endloskolben-Prinzip erfolgt die Dosierung absolut pulsationsfrei. Sowohl die Mischungsverhältnisse – von 1:1 bis 100:1 – als auch die ... -
Validierung von computergestütztem Equipment
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 03, Seite 172 (2020))
Validierung von computergestütztem Equipment / Beachtung der Datenintegrität im GMP-Bereich – Teil 1 · Spiller S · Testo Industrial Services, Kirchzarten
Equipmentqualifizierung Softwarevalidierung CSV-Konzept Datenintegrität Computerisiertes Equipment im GMP-Bereich Die Thematik der Sicherstellung von Datenintegrität bei Equipment nimmt an Bedeutung zu. Computerisiertes Equipment lässt sich hierbei je nach Komplexität in Gruppen einteilen. Während es für groß angelegte Server-Client-Varianten (z. B. Chromatographie-Systeme) bereits etablierte Validierungskonzepte gibt (basierend auf anerkannten Guidelines), ergeben sich bei der Validierung von sog. Stand-Alone-Equipment zahlreiche Fragen, die es zu lösen gilt, um den Guidelines zu entsprechen. Hierzu ist es sinnvoll, ein übergeordnetes risikobasiertes Validierungskonzept zu etablieren, das standardisiert auf eine Vielzahl an Stand-Alone-Systemen in Good-Manufacturing-Practice(GMP)-Bereichen der pharmazeutischen Industrie angewandt werden kann. Dieses Konzept sollte ein Risikomanagement über den gesamten ...
-
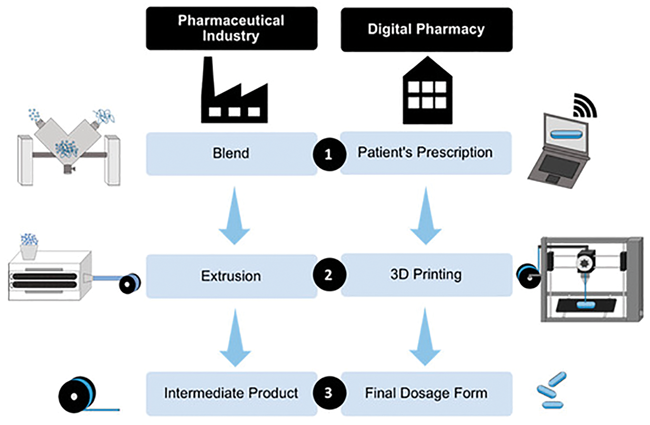
Additive Fertigung in der Arzneimittelproduktion
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 03, Seite 164 (2020))
Additive Fertigung in der Arzneimittelproduktion / Potenziale und Herausforderungen · Tidau M, Finke J · Institut für Partikeltechnik (iPAT), Zentrum für Pharmaverfahrenstechnik (PVZ), TU, Braunschweig
3D-Druck Additiver Herstellungsprozess Individualisierung Drucktechnologien 3D-gedruckte Arzneiformen Additive Fertigungsverfahren halten seit vielen Jahren Einzug in die verschiedensten Industriezweige. Dies gilt spätestens seit der Zulassung des von Aprecia Pharmaceuticals LLC. entwickelten 3D-gedruckten Antiepileptikums Spritam ® [ 1 ] durch die U.S. Food and Drug Administration (FDA) im Jahr 2015 auch für die Pharmaindustrie. Weitere Firmen (z. B. FabRx Ltd., Multiply Labs) haben sich der Entwicklung 3D-gedruckter Arzneiformen verschrieben und erste für die additive Fertigung von Arzneimitteln ausgelegte Anlagen (z. B. der AutoCompounder von Vitae Industries Inc. und Anlagen von DiHeSys GmbH) werden vertrieben. Allerdings wurde bislang trotz großem Forschungsaufwand [ 2 , ...
Sie sehen Artikel 2781 bis 2790 von insgesamt 11970
- Erste Seite
- 277
- 278
- 279
- 280
- 281
- Letzte Seite