Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-

Biometrische Authentifizierungslösungen
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 01, Seite 56 (2020))
Biometrische Authentifizierungslösungen / Produkte
Werum IT Solutions *) präsentiert K.ME-IN, eine biometrische Authentifizierungslösung für das PAS-X Manufacturing Execution System (MES). Die Lösung ermöglicht es Bedienern in der pharmazeutischen oder biopharmazeutischen Produktion, sich mit einem smarten Armband sicher und einfach an Systemen, Geräten und Maschinen anzumelden. Das System wird zukünftig eine Authentifizierung durch weitere biometrische Merkmale wie Irisscan, Gesichtserkennung, Fingerabdruck oder eine Kombination aus diesen Methoden ermöglichen. Das Armband kann unter jeder Art von Schutzkleidung getragen werden. -

Hocheffiziente Validierung von Sterilisations- und Gefriertrocknungsprozessen
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 01, Seite 55 (2020))
Hocheffiziente Validierung von Sterilisations- und Gefriertrocknungsprozessen / Spektrum
Sterilisations- und Gefriertrocknungsprozesse in der Pharmazie und Medizintechnik unterliegen aufgrund ihres unmittelbaren Einflusses auf die Gesundheit von Menschen strengen Richtlinien, weshalb Unternehmen verpflichtet sind, die spezifikationsgemäße Funktion der Autoklave, Reinigungs- und Desinfektionsgeräte (RDG) oder der Gefriertrocknungsanlagen zu qualifizieren sowie die Prozesse zu validieren. Für diese hochkomplexe Anwendung hat Testo das Datenloggersystem testo 190 entwickelt, das den Anwendern eine einfache und richtlinien-konforme Durchführung ermöglicht. Die Datenlogger testo 190 machen besonders durch ihr robustes Design auf sich aufmerksam: Die Messtechnik befindet sich in einem hermetisch verschlossenen Edelstahlgehäuse und die Batterien in einem separaten Gehäuse aus Polyetheretherketon (PEEK). Durch diese innovative Bauart ist ein schneller ... -

How to conduct successful forced degradation studies – Scope and regulatory requirements
Rubrik: GMP / GLP / GCP
(Treffer aus pharmind, Nr. 01, Seite 55 (2020))
How to conduct successful forced degradation studies – Scope and regulatory requirements / PART III*Part I of this article see Pharm. Ind. 2019;81(9):1192–6, Part II see Pharm. Ind. 2019;81(11):1481–9. · Buschmann H, Handler N · RD&C Research, Development & Consulting GmbH, Vienna, Austria
The requirements for conducting forced degradation studies are based on guidelines and recommendations of the International Council on Harmonisation (ICH) and national regulatory bodies like the FDA, EMA and ANVISA. Stability assessment is crucial for drug substance (DS) and drug product (DP), as impurities and degradation products may appear due to chemical breakdown leading to product failure. In-depth stability assessment including long-term (12 months) or accelerated (6 months) stability studies have impact on the current heavy time constraints of the drug development process and may increase the time to get the product to market. Therefore, beside data from forced degradation studies, complementing ...
-

15 Jahre GMPi
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 01, Seite 54 (2020))
15 Jahre GMPi / Spektrum
„Kreative Lösungen für individuelle Anforderungen“ – unter diesem Leitmotiv konstruiert und fertigt die GMPi Maschinen GmbH Maschinen und Ausrüstungen für die pharmazeutische, medizinische, chemische und kosmetische Industrie. Der Schwerpunkt liegt dabei auf Diagnostik, Life Science und nicht sterile Abfüllung. Das vor 15 Jahren gegründete Unternehmen hat seinen Sitz in Ilshofen im Landkreis Schwäbisch Hall, einem der Zentren der Abfüll- und Verpackungsmaschinenindustrie. Schritt für Schritt entwickelte sich GMPi weiter, denn zunächst war das Unternehmen nur auf den Bereich Gebrauchtmaschinen und deren Handel spezialisiert. Das änderte sich 2011. Seitdem werden auch Neumaschinen vertrieben, konstruiert, produziert und der Service durchgeführt. Das Produktportfolio wurde ... -
Drop-In-Lösung für die Gewährleistung eines Höchstmaßes an Sicherheit und Medikamentenwirksamkeit
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 01, Seite 52 (2020))
Drop-In-Lösung für die Gewährleistung eines Höchstmaßes an Sicherheit und Medikamentenwirksamkeit / Spektrum
Höchste Sicherheitsstandards sind gerade in der Pharmaindustrie unerlässlich. Hier gefertigte Produkte müssen nicht nur sicher sein, sondern auch genauestens geprüft werden, bevor diese in den Markt eingeführt werden und somit den Endverbraucher erreichen. Für Antares Vision hat höchste Priorität, die Sicherheit der Produkte und somit die Sicherheit des Endverbrauchers zu gewährleisten. Verschiedenste Inspektionssysteme und -maschinen des italienischen Unternehmens sorgen dafür, dass jegliche Fehler – ob an den Behältern, den Verschlüssen oder den Produkten selbst – erkannt und fehlerhafte Produkte und Behälter sofort aussortiert werden. Gerade bei der Inspektion lyophilisierter (gefriergetrockneter) Produkte und Flüssigkeiten liegt der Fokus besonders auf der Dichtigkeit ... -

Müller + Müller
Rubrik: Sonderteil CPhI 2019
(Treffer aus TechnoPharm, Nr. 01, Seite 50 (2020))
Müller + Müller / Sonderteil CPhI 2019
Müller + Müller *) war vom 05.–07. Nov. 2019 auf der wichtigsten Messe der pharmazeutischen Industrie vertreten. Wir nutzten zum wiederholten Male die Gelegenheit, unser Unternehmen und v. a. unsere Primärpackmittel aus Röhrenglas vorzustellen. Unsere Produktpalette umfasst Fläschchen (Vials) von 2–40 ml (Injektions-, Gewinde- und Rollrandflaschen), die standardmäßig im Reinraum nach ISO-Klasse-8-Vorgaben verpackt werden. Mögliche Sonderbehandlung: Ein hochmoderner Innen-Silikonisierungsprozess gewährleistet optimale Ergebnisse bei einem geringen Eintrag an Silikon im Glasfläschchen. Wir möchten uns auf diesem Weg ganz herzlich bei den zahlreichen Kunden und Besuchern aus dem In- und Ausland für ihr Interesse bedanken. -

OCTUM
Rubrik: Sonderteil CPhI 2019
(Treffer aus TechnoPharm, Nr. 01, Seite 50 (2020))
OCTUM / Sonderteil CPhI 2019
Nicht korrekt verschlossene Vials können zur Kontamination medizinischer Wirkstoffe führen – eine inline-optische Kontrolle ist daher zwingend erforderlich. Der maßgeschneiderte Sensorkopf mit 3 Kameras und Spiegelanordnung ermöglicht eine 360°-Kontrolle. Die Kameraauflösung wird entsprechend Ihrer Fehlerspezifikation und Geometrie festgelegt. Wir liefern Ihnen auch Isolator taugliche Edelstahl Ausführungen. Wir prüfen folgende Fehler: fehlende Kappen und Deckel fehlerhafte Bördelung (Form und Geometrie) Beschädigung der Kappen richtige Farbe von Kappen und Deckel Bedruckungskontrolle auf Bördelkappe und Flip-Offs -

Sanner GmbH
Rubrik: Sonderteil CPhI 2019
(Treffer aus TechnoPharm, Nr. 01, Seite 50 (2020))
Sanner GmbH / Sonderteil CPhI 2019
Modern, kindersicher und einfach im Gebrauch: Der neue TabTec-CR-Tablettenbehälter von Sanner verfügt über einen neuartigen Öffnungsmechanismus, der Kinder vor der versehentlichen Einnahme von Schmerzmitteln, Antidepressiva oder auch medizinischem Cannabis schützt. Der patentierte Press-&-Flip-Verschluss beugt dem Öffnen durch Kinder vor, ist für Erwachsene und v. a. auch für Senioren aber durch Drücken und gleichzeitiges Hochschieben der Verschlusskappe leicht zu handhaben. Das in den Boden integrierte Trockenmittel und die entsprechende Farbwahl schützen den Inhalt jederzeit vor Feuchte. Für eine hygienische und einfache Dosierung der Arzneimittel sorgt die integrierte Schüttöffnung. Die zertifizierte kindersichere Verpackung erfüllt alle regulatorischen Anforderungen (ISO 8317 (2003), PPPA 16 CFR Part 1700, DMF ... -
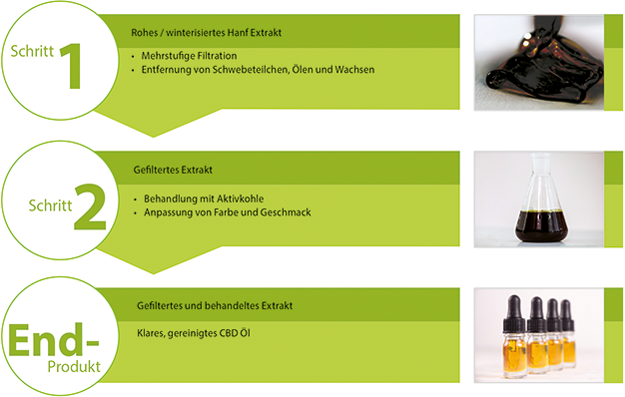
FILTROX
Rubrik: Sonderteil CPhI 2019
(Treffer aus TechnoPharm, Nr. 01, Seite 49 (2020))
FILTROX / Sonderteil CPhI 2019
Cannabisöle werden vermehrt in der kosmetischen und pharmazeutischen Industrie eingesetzt. Dies führt dazu, dass die Anforderungen an das Öl selbst immer höher werden. Ein entscheidender Schritt, neben einer optimierten Extraktion, ist die Aufreinigung des Öls nach der Extraktion. Die FILTROX AG bietet hierfür die entsprechenden Filtermedien wie auch das Equipment. In der Regel wird eine 3-stufige Aufreinigung empfohlen. Hierzu werden erst die Grobpartikel mit einem PURAFIX CH 09P Filtermedium entfernt, gefolgt von einer feineren Filtration mit einem PURAFIX CH 31 HP Filtermedium. Die so entstandene Lösung wird dann mit dem Aktivkohlefiltermedium CARBOFIL CA behandelt, um störende Farbpigmente und Chlorophyll zu entfernen. Genauere Informationen hierzu finden ... -

Faubel & Co. Nachf. GmbH
Rubrik: Sonderteil CPhI 2019
(Treffer aus TechnoPharm, Nr. 01, Seite 49 (2020))
Faubel & Co. Nachf. GmbH / Sonderteil CPhI 2019
Warum Smart-Label flexibel und langlebig sind, zeigte Faubel *) auf der CPhI Worldwide 2019. Ein Beispiel für ein Smart-Label, das analoge und digitale Elemente kombiniert, ist das Faubel-Med® Label. Multinationale klinische Studien benötigen oft eine mehrsprachige Kennzeichnung. Daher setzt sich das Med-Label aus einem seitenstarken Booklet-Etikett, einem E-Paper-Display und einem Radio-Frequency-Identification(RFID)-Tag zusammen. Das Verfallsdatum des Prüfpräparts steht zu Beginn einer Studie nicht immer fest. Verändern sich die Stabilitätsdaten, kann die Anzeige auf dem Display automatisch aktualisiert werden. Smart-Label sind somit flexibel und langlebig.
Sie sehen Artikel 2861 bis 2870 von insgesamt 11970
- Erste Seite
- 285
- 286
- 287
- 288
- 289
- Letzte Seite





