Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-
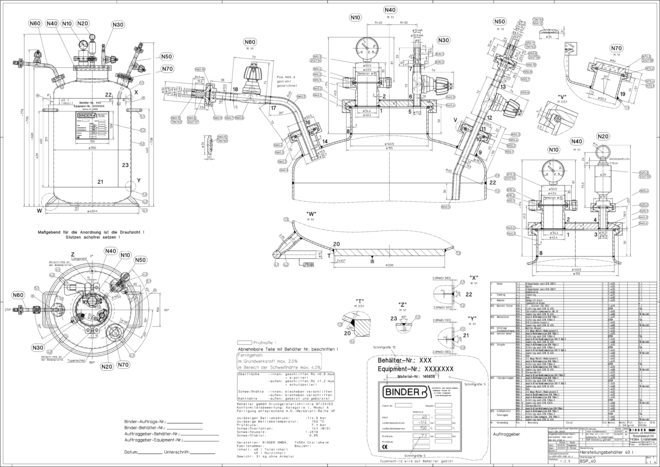
Schweißen in der Pharmazie
Rubrik: Produktionsumgebung
(Treffer aus TechnoPharm, Nr. 06, Seite 314 (2014))
Schweißen in der Pharmazie / (K)eine heiße Sache!? – Teil 1 · Warzawa M · Mühlacker
Zunächst hat „Schweißtechnik in der Pharmazie“ auffallend wenig mit dem Vorgang des Schweißens zu tun. Wer im Verlauf des Herstellungsprozesses von Behältern, Anlagen und vergleichbaren Komponenten keine bösen Überraschungen erleben möchte, muss zuerst eine ganze Reihe von Fragen beantworten und eine noch größere Menge stellen. Am ehesten lässt sich die Vorgehensweise mit einem Küchenchef vergleichen, dessen Restaurant zu einer Hochzeit oder einem runden Geburtstag reserviert wurde und der zumindest wissen muss: Wie viele Personen kommen? Aus wie vielen Gängen soll das Menü bestehen? Befinden sich unter den Bewirteten Vegetarier? Und natürlich: Wie teuer darf alles werden? Um all dies und ...
-
Gut abschneiden – Feindosierung in oralen Filmen
Rubrik: Produktionsumgebung
(Treffer aus TechnoPharm, Nr. 06, Seite 306 (2014))
Gut abschneiden – Feindosierung in oralen Filmen / Jansen und Horstmann • Feindosierung in oralen Filmen · Jansen J, Horstmann M · OPTIMA life science GmbH, Schwäbisch Hall und transdermalpharma UG, Neuwied
Grundlegend für die richtige Dosierung sind einerseits die richtige Mengenzugabe der einzelnen Inhaltsstoffe mittels rechnerischer Erfassung und Verfolgung bei den Basisprozessen und andererseits die Homogenität des Batch-Ansatzes in allen Produktionsphasen bis zum Trocknen des Films. Inhomogenitäten aufgrund der oft gezielten Nutzung von Polymer-Inkompatibilitäten, welche oft die unverwechselbare Güte des Zerfallsprozesses garantieren, müssen fertigungstechnisch früh als Risikofaktoren bedacht werden. Dabei bilden die Gehaltsspezifikation wie auch die Anwendungsvorschriften zur „Uniformity of dosage units“ nach European Pharmacopeia 5.2 Abschnitt 2.9.40 das regulatorische Rückgrat zur Akzeptanz noch erlaubter Abweichungen. Für die Filmherstellung leiten sich daraus drei alternative Herstellungsverfahren ab: Die homogenisierte Wirkstofflösung oder Dispersion ...
-
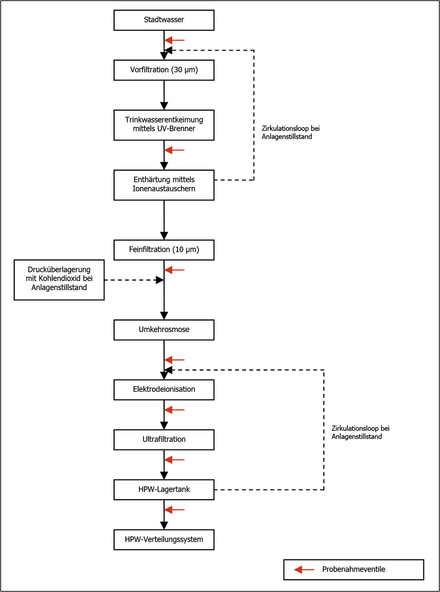
Integration von neuen Reinmedien-Versorgungssystemen bei laufendem Betrieb
Rubrik: Produktionsumgebung
(Treffer aus TechnoPharm, Nr. 06, Seite 296 (2014))
Meyer J | Letzner H | Multhauf M
Integration von neuen Reinmedien-Versorgungssystemen bei laufendem Betrieb / Neubau einer HPW-Erzeugung, Lagerung und Verteilung sowie eines Reinstdampferzeugers mit Verteilnetz ohne Unterbrechung der pharmazeutischen Produktion · Meyer J, Letzner H, Multhauf M · Richter Pharma AG, Wels (Österreich) und LETZNER Pharmawasseraufbereitung GmbH, Hückeswagen und Senior Consultant Pharmaingenieurwesen, Berlin
Die Richter Pharma AG ist ein Hersteller für Human- und Veterinärarzneimittel mit einem Werk in Wels / Oberösterreich. Das Unternehmen betreibt eine Lohnproduktion von wässrigen Injektionslösungen (sterile Liquida in Flaschen von 1-500 ml). Weiterhin werden an dem Standort feste Formen (Pulver und Tabletten) und halbfeste Formen (Salben und Gelee) hergestellt. Aufgrund der steigenden Kundenanforderungen und der guten Auftragslage wurde die Erneuerung der zwei älteren Reinstmedienanlagen gestartet. Die neuen Systeme wurden konzeptionell von Chemgineering geplant. Ab dem Basic Engineering übernahm die M+W Group die Planung und Bauüberwachung sowie die Unterstützung bei der Leistungsqualifizierung. Der Anlagenbauer Fa. LETZNER Pharmawasseraufbereitung GmbH erhielt den Auftrag ...
-
Aktuelle Technologietrends von der Messe TechnoPharm
Rubrik: Editorial
(Treffer aus TechnoPharm, Nr. 06, Seite 291 (2014))
Aktuelle Technologietrends von der Messe TechnoPharm / Editorial
Sehr geehrte Leser des TechnoPharm-Journals, wohl für alle produzierenden Pharmaunternehmen gilt gleichermaßen: Die Kosten müssen gesenkt werden, die Effizienz soll bei höchster Qualität immer weiter steigen, und in Sachen Sicherheit von Produkten und Bedienern gibt es keine Zugeständnisse. Immer kleinere Chargengrößen stellten die Pharmaproduzenten zudem bis vor kurzem noch vor nahezu unüberwindbare Herausforderungen. Ein ausgiebiger Besuch der POWTECH und TechnoPharm, die vom 30. September bis 2. Oktober in Nürnberg stattfanden, zeigt mir: Viele Pharma-Ausrüster sind den neuen Herausforderungen gewachsen. Immer breiter fällt das Angebot an Maschinen für die Containment-Produktion hochaktiver Wirkstoffe aus. Immer mehr Maschinen erfüllen die Forderungen nach schneller ... -

Tauchsensoren
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 823 (2014))
Tauchsensoren / pharmind • Produktinformationen
Mit dem neuen Liquisonic ® Tauchsensor Food & Pharma bietet SensoTech *) ein 3-A-zertifiziertes Messsystem für die Konzentrationsbestimmung in Flüssigkeiten an. In pharmazeutischen Prozessen werden zum Beispiel Lösungsmittel, Nährlösungen, Emulsionen oder Wirkstoffkristallisationen analysiert. In Kombination mit einem 3“-Clamp-Prozessanschluss wird der Sensor direkt in die Rohrleitung oder den Behälter eingebaut. Die Bauteile sind aus hochwertigem Edelstahl DIN 1.4404 gefertigt und für die CIP-Reinigung geeignet. Die robuste und vollständig gekapselte Konstruktion benötigt weder Dichtungen noch „Fenster“ zum Prozess. Der Sensor arbeitet daher vollständig wartungs-, drift- und belagsfrei. Zusätzlich zur Konzentrationsmessung verfügt der Sensor über eine hochpräzise Temperaturmessung und eine Flow/Stop-Überwachung. Die ... -

Agar- und Membrantransfersystem
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 822 (2014))
Agar- und Membrantransfersystem / pharmind • Produktinformationen
Sartorius Stedim Biotech *) präsentiert mit Microsart @media ein neues Agar- und Membrantransfersystem, welches der mikrobiologischen Qualitätskontrolle dient und die etablierte Produktreihe Microsart @vance ergänzt. Die neu eingeführten Agar-Medienschalen werden für den „Microbial Limits Test” gemäß der US-amerikanischen Pharmakopöe USP (Kapitel <61>) und der europäischen Pharmakopöe EP (Kapitel 2.6.12) zur Ermittlung mikrobieller Grenzwerte eingesetzt. Die Medienschalen sind mit unterschiedlichen Agar-Nährmedien befüllt, steril verpackt und in Kombination mit den Filtrationseinheiten der Sartorius-Produktlinie Microsart @filter sofort einsatzbereit. Ein patentierter Deckel ermöglicht den berührungsfreien Transfer der Membran ganz ohne den üblichen Einsatz von Pinzetten. Ein separat abnehmbarer Deckel des Systems erlaubt zudem eine ... -

Pharmafläschchen-System
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 822 (2014))
Pharmafläschchen-System / pharmind • Produktinformationen
Mit adaptiQ stellt Schott *) ein neues System abfüllfertiger Pharmafläschchen vor, das in enger Zusammenarbeit mit Abfülllinienherstellern an die Prozessanforderungen der pharmazeutischen Industrie angepasst wurde. Das System besteht aus einer so genannten Nest-und-Tub-Konfiguration, bei der bis zu 100 Fläschchen in einer Halterung (Nest) sicher fixiert sind und steril verpackt an den Pharmazeuten geliefert werden. Dieser kann die Fläschchen dann direkt auf der Abfüllanlage befüllen. Prozessschritte wie Waschen, Trocknen und Sterilisieren entfallen beim Pharmazeuten. Mit diesem patentierten System ist erstmals das Gefriertrocknen, Wiegen oder Verschließen im Nest möglich. Neben der Prozessvereinfachung steht hierbei vor allem der Schutz der Glasbehältnisse im ... -

TOC-Analytik
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 822 (2014))
TOC-Analytik / pharmind • Produktinformationen
Analytik Jena *) hat einen hochwertigen Focus Radiation NDIR-Detektor ® für TOC-Analytik eingeführt. Hier wird die IR-Strahlung auf den Mikrodetektor fokussiert, wobei die Strahlungsdichte nach Unternehmensangaben klassische Detektoren um ein Vielfaches übertrifft. Energieverluste wie bei korrosionsanfälligen Reflexionsdetektoren entfallen. Die hohe Empfindlichkeit und Langzeitstabilität des Detektors beruhen auf den völlig korrosionsfreien Materialien in der Gasküvette – ein wirksamer Schutz gegen aggressive Proben. Die elektronisch gepulste Strahlungsquelle ermöglicht den Verzicht auf mechanisch bewegliche und damit störanfällige Teile. So sind aufwendige Detektorwartungen überflüssig, die Lebenserwartung höher und die Betriebskosten reduziert. Der Weitbereichsdetektor erlaubt das Messen unverdünnter wässriger Proben im Konzentrationsbereich von 0–30 000 mg/l. ... -

Tablettenpressen
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 822 (2014))
Tablettenpressen / pharmind • Produktinformationen
Für eine hohe Qualität in der Tablettierung hat Fette Compacting *) eine neue Generation von Tablettenpressen entwickelt: Die FE Serie verbindet effiziente Produktion mit einem einfachen Bedienkonzept. Zu den Modellen dieser Maschinenserie gehören die Tablettenpresse FE35, ein auf den schnellen Produktwechsel optimierter Einfachrundläufer, die FE55, mit einem guten Verhältnis von Stempelzahl zur Grundfläche (bis zu 87 Stempel auf 1,6 m 2 ) und die FE 75, ein Hochleistungs-Doppelrundläufer mit einer Produktionsleistung von bis zu 1,6 Mio. Tabletten pro Stunde. Hinter dem Aufbau und der Bedienung der FE Serie steht das Design-Konzept TRI.EASY, das den Anwender in den Mittelpunkt stellt. Die Bedienung ... -

Sauerstoff-Sensoren
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 05, Seite 822 (2014))
Sauerstoff-Sensoren / pharmind • Produktinformationen
Mit dem VisiPro DO Ex hat Hamilton *) den ersten optischen Sensor entwickelt, der für die Messung von gelöstem Sauerstoff in explosionsgefährdeter Umgebung zugelassen wurde. Gegenüber herkömmlichen elektrochemischen (ampèrometrischen) Sensoren arbeitet dieser Sensor unabhängig von der Durchflussmenge und ist ohne Polarisierungszeit besonders schnell einsetzbar. Die optische Messtechnologie verbessert die Messleistung und vereinfacht die Wartung. Der Sensor ist für einen Temperaturbereich zwischen – 10 °C und 140 °C und einem Druck von bis zu 12 bar zugelassen. Ein integrierter Transmitter ermöglicht eine direkte Kommunikation mit dem Prozessleitsystem über ein 4-20-mA-Zweileiter-Standardsignal oder ein digitales HART-Signal. Alle relevanten Sensordaten einschließlich der Kalibrierungs- und Diagnoseinformationen werden ...
Sie sehen Artikel 5991 bis 6000 von insgesamt 11938
- Erste Seite
- 598
- 599
- 600
- 601
- 602
- Letzte Seite