Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11911 Beiträge für Sie gefunden
-
Wissenschaftstheorie
Rubrik: Aus Wissenschaft und Forschung
(Treffer aus pharmind, Nr. 01, Seite 20 (2022))
Wissenschaftstheorie / Die Grenzen des Naturerkennens · Stoll G · Filderstadt
Vor 150 Jahren hielt der Physiologe Emil du Bois-Reymond vor der Versammlung deutscher Naturforscher und Ärzte einen vielbeachteten Vortrag über die Grenzen des Naturerkennens. Er erntete damit völlige Zustimmung und ebenso heftige Ablehnung, da er bestimmte Fragestellungen für naturwissenschaftlich nicht lösbar hielt, eine heikle Haltung in einer Zeit großer Wissenschaftsgläubigkeit. Bis heute sind seine 7 Welträtsel immer wieder im Licht aktueller naturwissenschaftlicher Erkenntnisse diskutiert worden. Sind sie heute gelöst?
-
Intelligente Formatverstellung für mehr Prozesssicherheit in der pharmazeutischen Produktion
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 01, Seite 20 (2022))
Intelligente Formatverstellung für mehr Prozesssicherheit in der pharmazeutischen Produktion / Schuh • Formatverstellung · Schuh J · SIKO GmbH, Bad Krozingen
Formatverstellung Centerlining Formatwechsel Produktionsmaschinen Verpackungsmaschinen Innerhalb der pharmazeutischen Branche ist der Wettbewerbsdruck hoch, und es reicht nicht mehr aus, innerhalb kurzer Zeit möglichst hohe Stückzahlen eines Produkts zu fertigen. Hinzu kommen strenge und sich immer wieder ändernde Regularien, nach denen es die Produktionsprozesse auszurichten gilt. Produkte müssen effizient und dabei zuverlässig hergestellt werden. Bei wachsender Produktvielfalt sowie immer kleineren Chargengrößen steigen die Anforderungen an die Flexibilität von Produktionsanlagen. Es geht um die optimale Anlagenverfügbarkeit und die Reduzierung von Stillstands- und Rüstzeiten bei kleinsten Losgrößen. Im Sinne des Centerlining wird im Pharmabereich angestrebt, während des Produktionsprozesses stets die optimalen Einstellungen und ...
-
Aspekte der Reinraumkonstruktion bei Arbeiten mit Hochrisikosubstanzen
Rubrik: Planung
(Treffer aus cleanroom & processes, Nr. 01, Seite 24 (2022))
Aspekte der Reinraumkonstruktion bei Arbeiten mit Hochrisikosubstanzen / Fokus auf biogefährdende Substanzen · Pink T · Laufenburg
Reinraumkonstruktion Anlagendesign Biohazard Biosafety Zukunftstrends Im Bereich der pharmazeutischen Produktion, in Forschung und Entwicklung, für medizinische Dienstleistungen, oder um den Schutz der Bevölkerung durch Forschung und Monitoring zu gewährleisten, ist es manchmal unvermeidlich, Arbeiten mit hochaktiven, gefährlichen Substanzen durchzuführen. Diese Substanzen können nach ihren Eigenschaften und ihrer Wirkung unterteilt werden. Es werden biologische, strahlungsbedingte oder chemische Gefahren diskutiert (Bezeichnung als NBC = nuclear, biological and chemical, heute oft auch als CBRN = chemical, biological, radiological and nuclear defence). Bei der Arbeit mit gefährlichen Stoffen steht der Schutz von Mensch und Umwelt an erster Stelle. Dies ist das Grundprinzip, um beides vor akuten und langfristigen ...
-
APONTIS PHARMA
Rubrik: In Wort und Bild
(Treffer aus pharmind, Nr. 01, Seite 26 (2022))
APONTIS PHARMA / pharmind • In Wort und Bild
Die APONTIS PHARMA AG, ein führendes Pharmaunternehmen für Single Pills in Deutschland, hat ihr Management für das künftige Wachstum erweitert und hat Thomas Zimmermann zum Chief Financial Officer (CFO) ernannt. Herr Zimmermann verstärkt seit 01. Jan. 2022 das Management um Chief Executive Officer (CEO) Karlheinz Gast und Chief Product Officer (CPO) Thomas Milz. Als CFO übernimmt Thomas Zimmermann Verantwortung für die Bereiche Finance, Supply Chain und IT. Thomas Zimmermann verfügt über rund 25 Jahre Erfahrung in verantwortungsvollen Positionen mit Schwerpunkt Finanzen in der Pharmabranche. Zuletzt war er in Deutschland und Österreich als Finance Director für das Schweizer Pharmaunternehmen Galderma sowie als Steuerberater-Syndikus ... -
Aktuelles aus G-BA und IQWiG
Rubrik: Gesundheitswesen
(Treffer aus pharmind, Nr. 01, Seite 27 (2022))
Aktuelles aus G-BA und IQWiG / Aktuelle Verfahren der Frühen Nutzenbewertung / Arzneimittelbezogene Beschlüsse des G-BA im Nov./Dez. 2021 · Wilken M, Lietz C · Bundesverband der Pharmazeutischen Industrie (BPI) e. V., Berlin
Es ist zu beachten, dass die Beschlüsse zur Frühen Nutzenbewertung bereits vor Veröffentlichung im Bundesanzeiger in Kraft treten. Deshalb können Veröffentlichungsdatum und das Datum des Inkrafttretens auseinanderfallen. Beschlüsse des G-BA vom 19. Nov. 2021 zur Änderung der AM-RL in Anlage XII (Verfahren nach § 35a Sozialgesetzbuch (SGB) V): Atezolizumab: neues Anwendungsgebiet: nichtkleinzelliges Lungenkarzinom, PD-L1-Expression ≥ 50 % der Tumorzellen (tumour cells, TC) oder ≥ 10 % bei tumorinfiltrierenden Immunzellen (immune cells, IC), Epidermal-Growth-Factor-Receptor/anaplastische Lymphomkinase (EGFR/ALK)-negativ, Erstlinie Bosutinib: Neubewertung nach Fristablauf: chronische myeloische Leukämie, Ph+, Erstlinie Cenobamat: Epilepsie, fokale Anfälle, nach mindestens 2 Vortherapien Enzalutamid: neues Anwendungsgebiet: Prostatakarzinom, metastasiert, hormonsensitiv, Kombination mit Androgenentzugstherapie Ivacaftor/Tezacaftor/Elexacaftor neues Anwendungsgebiet: zystische ...
-
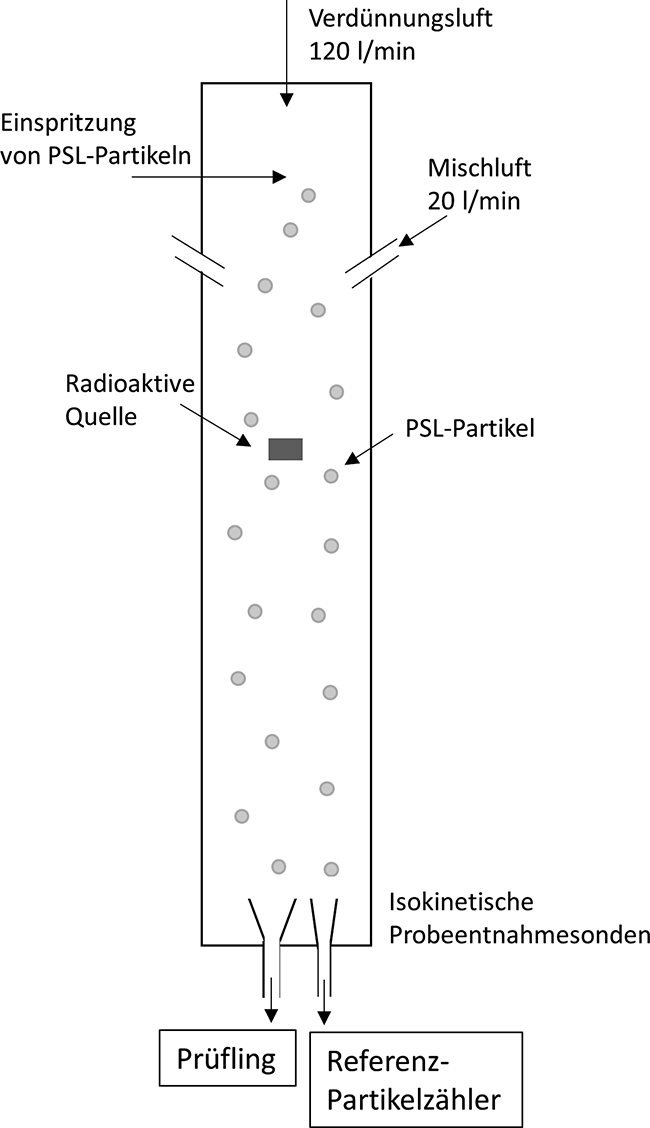
Kalibrierung von optischen Partikelzählern
Rubrik: Messen/Steuern/Regeln
(Treffer aus TechnoPharm, Nr. 01, Seite 28 (2022))
Horender S | Auderset K | Vasilatou K
Kalibrierung von optischen Partikelzählern / Überwachung von Reinräumen in der pharmazeutischen Industrie · Horender S, Auderset K, Vasilatou K · Eidgenössisches Institut für Metrologie METAS, Bern-Wabern (Schweiz)
Aerosol Optischer Partikelzähler Kalibrierung Reinraum Pharmazeutische Industrie Optische Partikelzähler (optical particle counters – OPCs) werden zunehmend in Reinräumen(z. B. in der Halbleiterindustrie, in medizinischen und pharmazeutischen Umgebungen) zur Überwachung der Anzahlkonzentration von luftgetragenen Partikeln eingesetzt. Ein Reinraum ist ein geschlossener und streng kontrollierter Raum, in dem luftgetragene Partikel, Kontaminationen und Schadstoffe minimiert werden. In der Industrie werden Reinräume bei der Herstellung und Wartung von Hardware (z. B. integrierten Schaltkreisen und Festplatten) eingesetzt. In der Biotechnologie und den pharmazeutischen Wissenschaften werden Reinräume verwendet, um die Anwesenheit von Bakterien, Viren und anderen Krankheitserregern zu minimieren. Eine Kontamination kann die Qualität der hergestellten Produkte oder ...
-
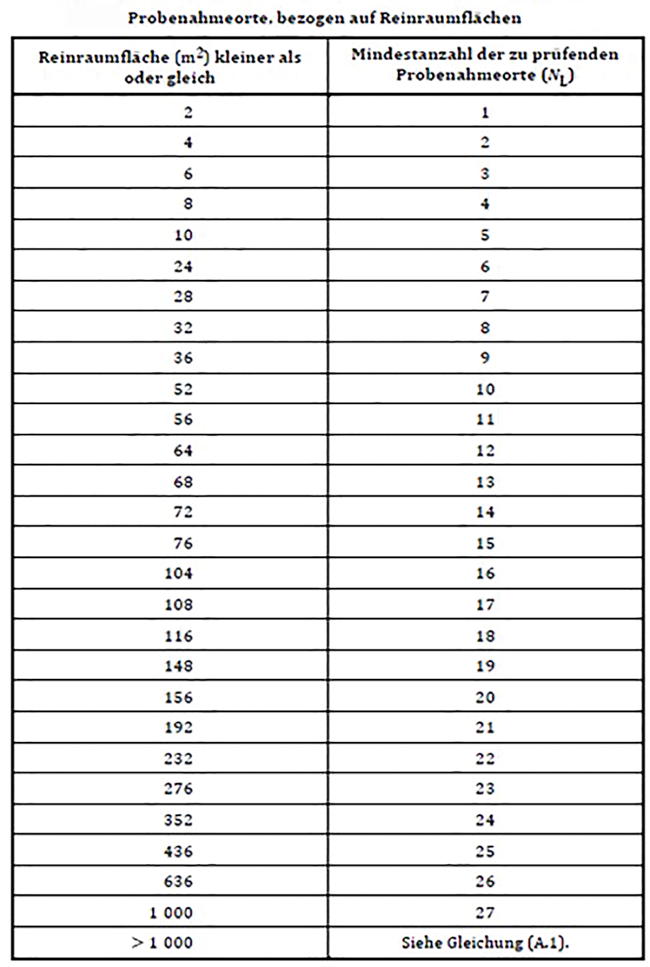
Risikobasierte Festlegung von Monitoringpunkten im aseptischen Herstellbereich
Rubrik: Messen/Steuern/Regeln
(Treffer aus cleanroom & processes, Nr. 01, Seite 32 (2022))
Risikobasierte Festlegung von Monitoringpunkten im aseptischen Herstellbereich / Gavranovic und Mathe • Monitoringpunkte · Gavranovic C, Mathe G · PPT Pharma Process Technology GmbH, Frankfurt am Main
Monitoring Aseptik Isolator RABS risikobasiert Die Überwachung der Sterilität der Produktionsumgebung der Reinraumklasse A/ISO 5 erfolgt über ein aktives und passives Monitoringsystem der kritischen Einflussfaktoren. Bei diesen handelt es sich um Luft- und Oberflächenkeime, Partikel, Luftgeschwindigkeit, Druck, Feuchte und Temperatur. Da es sich bei den Räumen der Reinraumklasse A/ISO 5 um Restricted-Area-Barrier-Systems (RABS) oder Isolator-Technologien handelt, sind die Monitoringpunkte fester Bestandteil der Anlage. Aus diesem Grund müssen Bewertung und Festlegung der Monitoringpunkte schon in einer frühen Projektphase erfolgen und im Rahmen des Design-Review bestätigt werden. In der hier vorgestellten Fallstudie wird die risikobasierte Festlegung der aktiven Monitoringpunkte für Luftkeime und Partikel beschrieben. ...
-
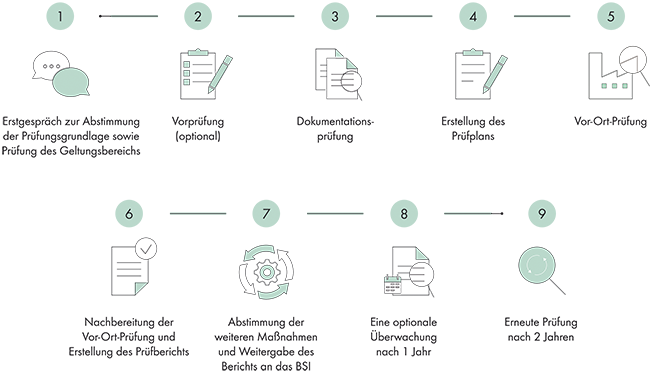
Informationssicherheitsmanagement
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 01, Seite 34 (2022))
Mettler H | Jans M | Kurpiela D
Informationssicherheitsmanagement / B3S KRITIS im Pharmaumfeld · Mettler H, Jans M, Kurpiela D · Exyte Central Europe GmbH, Stuttgart und DEKRA Certification GmbH, Stuttgart und DEKRA Certification GmbH, Berlin
KRITIS B3S Pharma ISO 27001 Informationssicherheitsmanagement Cyber Security Dass allgemein der Gesundheitssektor eine wichtige gesellschaftliche und wirtschaftliche Bedeutung für unser Gemeinwesen hat, ist sicherlich keine Neuigkeit. Nicht unbedingt bekannt ist, dass der deutsche Gesundheitssektor 2009 vom Gesetzgeber im Rahmen der Nationalen Strategie zum Schutz der Kritischen Infrastrukturen als sog. Kritische Infrastruktur (KRITIS) eingeordnet wurde. Damit sind Organisationen oder Einrichtungen gemeint, die eine große Bedeutung für das staatliche Gemeinwesen haben und bei deren Ausfall oder Beeinträchtigung nachhaltig wirkende Versorgungsengpässe, erhebliche Störungen der öffentlichen Sicherheit oder andere dramatische Folgen eintreten würden. Bestimmte Betreiber der Pharmaindustrie, Labore, Krankenhäuser und Vertriebsorganisationen müssen daher seit ...
-
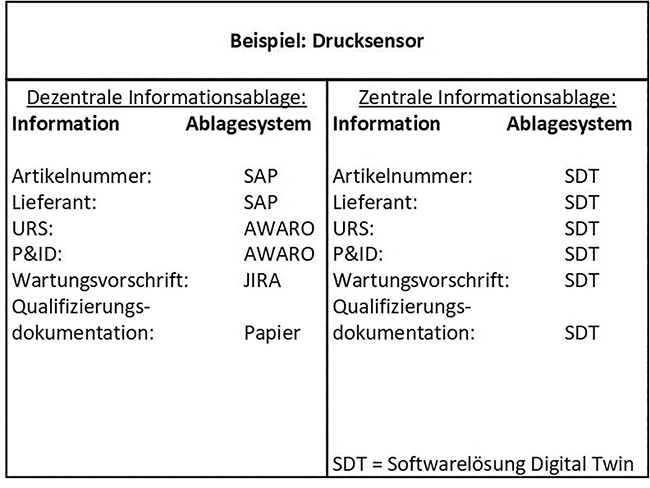
Chancen und Herausforderungen der Digitalisierung von Planungs-, Routine- und Instandhaltungsprozessen in der Pharmaindustrie
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 01, Seite 42 (2022))
Fuhrmann S | Tschorn M | Mathe G
Chancen und Herausforderungen der Digitalisierung von Planungs-, Routine- und Instandhaltungsprozessen in der Pharmaindustrie / Fuhrmann et al. • Digitalisierung · Fuhrmann S, Tschorn M, Mathe G · PPT Pharma Process Technology GmbH, Frankfurt am Main
Digital Twin Pharma 4.0 Industrie 4.0 Life Cycle Management Smart Manufacturing Es gibt vielfältige Möglichkeiten und Techniken, die zukünftig in der Phase der Planung und Umsetzung pharmazeutischer Produktionsanlagen Anwendung finden können. Dazu zählen z. B. das Internet of Things (IoT), die Verwendung von Virtual-Reality(VR)-Simulationen oder auch der Einsatz cyber-physischer Systeme (CPS). Ein CPS, das großes Potenzial für die Verbesserung von Planungsphasen aufweist, ist der digitale Zwilling. Daher soll im Folgenden erläutert werden, was ein digitaler Zwilling ist, wie er zukünftig in der Planungsphase eingesetzt werden kann, sowie welche Voraussetzung geschaffen werden müssen, um diese Technik zu etablieren. Ein digitaler Zwilling (engl. ...
-
Prüfung von Desinfektionsmitteln für den Einsatz gegen Pilze am Beispiel einer ATMP-Produktion
Rubrik: Reinigung & Desinfektion
(Treffer aus cleanroom & processes, Nr. 01, Seite 44 (2022))
Polarine jr. J | Klein D | Pfülb A
Prüfung von Desinfektionsmitteln für den Einsatz gegen Pilze am Beispiel einer ATMP-Produktion / Polarine jr. et al. • Desinfektionsmittel gegen Pilze · Polarine jr. J, Klein D, Pfülb A · STERIS Deutschland GmbH, Köln
Desinfektion ATMP Hygiene Contamination Control Strategy Kontaminationen mit Pilzen sind weltweit nach wie vor ein Problem in Herstellungsbetrieben im Bereich von Pharma, Biotech, Medizinprodukten, bei Cannabis-Herstellern und auch bei herstellenden Apotheken. Aspergillus, Cladosporium, Chaetomium, Acremonium und Penicillium stellen nur einige der Pilzarten dar, die im Hygienemonitoring auftreten. Einige der häufigsten Quellen waren die Rollen von Reinraumwagen, Geräte, Kunststoffbehälter, Marker, Kisten, Mobiltelefone und Werkzeuge: So wurde z. B. Aspergillus unter einem Brutschrank gefunden, der in einen Reinraumbetrieb gebracht wurde. Penicillium war eine Kontaminationsquelle auf Türen mit Wabenstruktur und auf Türen aus rostfreiem Stahl mit Sperrholz als Innenkomponente [ 1 , 2 ]. ...
Sie sehen Artikel 10041 bis 10050 von insgesamt 11911
- Erste Seite
- 1003
- 1004
- 1005
- 1006
- 1007
- Letzte Seite