Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11938 Beiträge für Sie gefunden
-
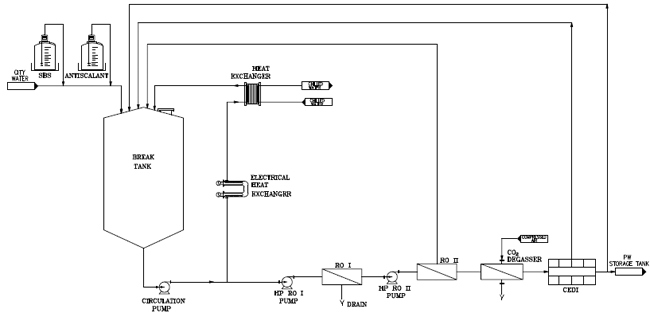
Vergleich zweier Double-Pass-RO-Systeme zur PW-Herstellung
Rubrik: Maschinen- und Anlagenbau
(Treffer aus TechnoPharm, Nr. 05, Seite 288 (2018))
Vergleich zweier Double-Pass-RO-Systeme zur PW-Herstellung / Chemische Vorbehandlung (SBS, AS) versus elektrische Vorbehandlung (ESR, HOD) · Sackstein S · Biopuremax Ltd, Hasdnaot (Israel)
Water for Injection (WFI) Purified Water (PW) Reverse Osmosis (RO) Wassersystem pharmazeutisch Bei dem ersten System (System 1) erfolgt die Vorbehandlung auf der Basis eines Kalkhemmers (antiscalant, AS), um der Abscheidung von Kalk bei der Umkehrosmose vorzubeugen. Außerdem wird Natriumbisulfit (sodium bisulfite, SBS), besser bekannt als Natriummetabisulfat (sodium metabisulfate, SMBS), zur Entfernung von freiem Chlor eingesetzt. Bei dem zweiten System (System 2) basiert die Vorbehandlung auf einer elektrolytischen Kalkreduktion (electrolytical scale reduction, ESR), um der Kalkabscheidung bei der Umkehrosmose vorzubeugen, sowie auf einer hydrodynamischen optischen Entchlorung (hydrodynamic optic de-chlorination, HOD) zur Entfernung von freiem Chlor. Bei beiden Systemen kommen die Double-Pass-Umkehrosmose (double ...
-
Pharmazeutische Isolatortechnologie
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 05, Seite 282 (2018))
Pharmazeutische Isolatortechnologie / Schicht • Isolatortechnologie · Schicht H · selbstständiger Unternehmensberater, Zumikon (Schweiz)
Sterilitätssicherheit Isolator Sterilitätstest kontinuierlicher Prozess Biodekontamination Als steril gilt ein Produkt, wenn in 1 Mio. individueller Verpackungseinheiten maximal eine einzige mikrobiologisch kontaminiert ist. Dieser Forderung – also einer Sterilitätssicherheit, die mindestens einem Sterility-Assurance-Level(SAL)-Wert von 10 - 6 entspricht – haben endsterilisierte Arzneimittel zu genügen. Für die aseptische Herstellung von Arzneimitteln gemäß der Industrie-Leitlinie der U.S. Food and Drug Administration (FDA) für die aseptische Herstellung sowie des Anhangs 1 zum Good-Manufacturing-Practice(GMP)-Leitfaden der EU die in Abb. 1 wiedergegebenen Mindestanforderungen. Diese hinken noch um 2 Zehnerpotenzen hinter dem SAL-Wert für endsterilisierte Produkte her. Vor diesem Hintergrund leuchtet die Auffassung der Behörden ein, die abgefüllten Einheiten auch ...
-
Die sichere und zuverlässige Prüfung von pharmazeutischen Proben auf Sterilität in einem Isolator
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 05, Seite 274 (2018))
Die sichere und zuverlässige Prüfung von pharmazeutischen Proben auf Sterilität in einem Isolator / Bässler • Sterilitätsprüfung · Bässler H · SKAN AG, Allschwil (Schweiz)
Aseptischer Isolator Sterilpüfung H 2 O 2 -Dekontamination H 2 O 2 -Raumüberwachung Kurze Zykluszeit Die Prüfung auf Sterilität eines parenteral anwendbaren Produktes der pharmazeutischen Industrie erfolgt nach USP <71> und Ph. EUR. 2.6.1. angewendet auf Substanzen, „die nach der Pharmakopöe steril sein müssen (parenteral, ophthalmisch etc.)“. Es ist der entscheidende Test für die Freigabe einer produzierten Charge auf dem Markt[ 1 ]. Sterilitätstests in Isolatoren werden von den Behörden in den USA und Europa mehr und mehr empfohlen. So sagt die Guidance der US Food and Drug Administration (FDA) für die Industrie: „Ein gut konstruierter Isolator im Überdruck, mit Überwachung und Kontrolle, ...
-
Aufbau moderner Monitoringsysteme
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 05, Seite 266 (2018))
Aufbau moderner Monitoringsysteme / Müller und Grüttner-Mierswa • Monitoringsysteme · Müller M, Grüttner-Mierswa D · vali.sys gmbh, Wetzikon (Schweiz)
Monitoring Umweltsensoren Partikelzähler Messtechnik GMP Rein ist nicht gleich rein. Um einen Reinraum gemäß seiner Klassifizierung als „rein“ zu bezeichnen, bedarf es einer professionellen Überwachung. In einem Reinraum gibt es kritische Stellen, i. d. R. Prozesse, die mit einem kontinuierlichen Partikel- und oder Umweltmonitoring überwacht werden müssen. Diese sind mit einem Datenerfassungs- und Auswertsystem sowie einer dazugehörigen Supervisory-Control-and-Data-Acquisition(SCADA)-Software verbunden. Verwendet werden v. a. Partikelzähler mit 2–4 Kanälen, die z. B. Partikelgrößen von 0,5–5 μm erfassen. Zusätzlich werden meistens Sensoren zur Erfassung von Temperatur relativer Feuchte, Differenzdruck und Luftgeschwindigkeit an den jeweils zu bestimmenden Orten installiert und anschließend in die Software eingebunden. Die Faustregel besagt, dass pro ...
-

Prüfungen kann man wiederholen – Partys nicht!
Rubrik: Editorial
(Treffer aus TechnoPharm, Nr. 05, Seite 261 (2018))
Prüfungen kann man wiederholen – Partys nicht! / Editorial
Sehr geehrte Leser des TechnoPharm-Journals, im Juni 2018 veröffentlichte Wiseguy Research Consultants seinen „Global Cleanroom Technology Market Report 2018“. Das indische Marktforschungsunternehmen sagt aus, dass in den vergangenen 4 Jahren nicht nur das globale Wirtschaftswachstum, sondern auch das Wachstum der globalen Reinraumtechnologiebranche einen Dämpfer erlitten hat. So weit, so kaum überraschend – aber keine Sorge: Mit einer durchschnittlichen jährlichen Wachstumsrate um (immer noch respektable) 5,5 % von 2,9 Mrd. US-Dollar (2014) auf 3,4 Mrd. US-Dollar (2017) muss sich niemand in einen Rupfensack kleiden, sich Asche aufs Haupt streuen oder sich sogar unter die Flagellanten begeben! Pharmaproduktion ist ohne Reinraum undenkbar. Dieser Tatsache ... -

Membranen
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 04, Seite 579 (2018))
Membranen / pharmind • Produktinformationen
Endress+Hauser *) bringt die neue TempC-Membran-Technologie (Temperature Compensatory Membrane) auf den Markt. Diese neue Membran-Technologie wurde entwickelt, um die Sicherheit und die Produktivität der Prozesse weiter zu erhöhen und dabei gleichzeitig die Anschaffungs- und Lebenszykluskosten zu senken. Die Membran reduziert im Vergleich zu konventionellen Membranen Prozess- und Umgebungstemperatureffekte bis zum Fünffachen. Durch die asymmetrische Geometrie und die geringere Steifigkeit der Membran wird der Ausdehnungseffekt des Füllöls reduziert. Dadurch werden der Temperaturfehler minimiert und gleichzeitig durch die bessere Messgenauigkeit eine höhere Prozesssicherheit erreicht. Die Sensoren Cerabar PMP55, Cerabar PMP75, Deltabar FMD77 und Deltabar FMD78 sind mit TempC in Kombination mit ... -

Vakuumtrockner
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 04, Seite 579 (2018))
Vakuumtrockner / pharmind • Produktinformationen
Der neue De-Dietrich *) -Kugeltrockner gewährleistet durch seinen beheizten Dreiarmrührer mit geringem Wandabstand eine völlige Durchmischung und kurze Trocknungszeiten. Durch ein totraumfreies Ablassventil mit optionaler Abfüllvorrichtung am tiefsten Punkt des Kugeltrockners wird ein vollständiger und rückstandsfreier Produktaustrag sichergestellt. Über ausfahrbare Reinigungsdüsen mit rotierenden Sprühköpfen kann Reinigungsflüssigkeit unter Druck in den Trockner versprüht werden. So können sämtliche Reinigungsvorgänge (WIP/CIP) im montierten Zustand durchgeführt werden. Durch einen hydraulisch angetriebenen Bajonett-Verschluss am Hauptflansch und ein Scharnier zwischen den beiden Kugelhälften ist eine Inspektion sehr einfach durchzuführen Der Trockner ist als Edelstahlausführung erhältlich. Für hochkorrosive Anwendungen steht auch eine Werkstoffvariante mit Nickelbasislegierung zur Auswahl, ... -

Metallsuchtechnik
Rubrik: Produktinformationen
(Treffer aus pharmind, Nr. 04, Seite 579 (2018))
Metallsuchtechnik / pharmind • Produktinformationen
Mettler-Toledo Safeline *) hat auf Basis der Signature-Plattform eine HDS-Pipeline-Metallsuchlösung entwickelt, die gezielt für den Einsatz in Vakuum-Abfülllinien vorgesehen ist. Sie ist vollständig aus Edelstahl gefertigt und in Schutzart IP69K ausgeführt. Eisenmetalle, Nicht-Eisenmetalle und selbst schwierig zu erkennende, nicht magnetische Edelstahl-Fremdkörper werden zuverlässig erkannt. HDS-Pipeline-Systeme detektieren auch nicht kugelförmige Fremdkörper wie z. B. Metallclips, Draht sowie Metallspäne oder -splitter, die beim Zerkleinern in das Produkt gelangen können. Das kurze Durchlassrohr und die Verwendung der ZMFZ-Technologie (metallfreie Zone) von Safeline verhindern effektiv ein Verschmieren des Produkts. Bei Erkennung eines Metallfremdkörpers unterbricht das System durch ein entsprechendes Signal den Betrieb des Vakuumfüllers, damit ... -

10 Jahre Packaging Excellence Center – Gemeinsam durch Innovation an die Spitze
Rubrik: Partner der Industrie
(Treffer aus pharmind, Nr. 04, Seite 578 (2018))
10 Jahre Packaging Excellence Center – Gemeinsam durch Innovation an die Spitze / pharmind • Partner der Industrie
Als Musterbeispiel eines organisch gewachsenen Unternehmensclusters weißt das Packaging Excellence Center (PEC) in der Region Stuttgart eine einzigartige Konzentration von Unternehmen der Verpackungs- und Automatisierungstechnik in jeder Größenordnung auf. Um die Stärken dieser zukunftsorientierten Branche zu bündeln und ihr vorhandenes Potenzial voll ausschöpfen zu können, wurde am 26. Okt. 2007 das Packaging Excellence Center als moderierte Kooperationsplattform ins Leben gerufen. Zu den 36 Gründungsmitgliedern zählen Unternehmen wie Harro Höfliger und Bosch Packaging Technology, außerdem Hochschulen und weitere Institutionen aus der Region Stuttgart. In den letzten 10 Jahren konnte das PEC Unternehmen der Verpackungstechnik in der Region nachhaltig vernetzen. Als Kooperationsplattform unter ... -

Drug Delivery Innovation Center am INVITE Forschungszentrum gestartet
Rubrik: Partner der Industrie
(Treffer aus pharmind, Nr. 04, Seite 577 (2018))
Drug Delivery Innovation Center am INVITE Forschungszentrum gestartet / pharmind • Partner der Industrie
Bei der Entwicklung moderner Arzneimittel bedarf es heutzutage immer größerer Anstrengungen, um Herausforderungen wie schlechter Wirkstofflöslichkeit oder niedriger Bioverfügbarkeit gerecht zu werden. Fortschrittliche Herstellungsmethoden, wie z. B. kontinuierliche Herstellverfahren oder 3-D-Druck für patientenindividualisierte Therapiemöglichkeiten, gewinnen zunehmend an Bedeutung und stellen einen Paradigmenwechsel der Arzneimittelherstellung im 21. Jahrhundert dar. Dies haben auch die Zulassungsbehörden wie die US FDA oder die EMA erkannt, was dazu führt, dass sie einem konstruktiven Dialog mit Industrie und Wissenschaft offen gegenüberstehen und neue Entwicklungen maßgeblich unterstützen. Diese Neuerungen sind für die pharmazeutische Industrie jedoch auch mit weiteren Herausforderungen verbunden. Fundiertes Prozessverständnis muss durch intensive Forschung erarbeitet werden. Daher ...
Sie sehen Artikel 3691 bis 3700 von insgesamt 11938
- Erste Seite
- 368
- 369
- 370
- 371
- 372
- Letzte Seite