Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Track & Trace-System
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 128 (2017))
Track & Trace-System / Produkte
Atlantic Zeiser *) stellt das völlig neuentwickelte Track & Trace-System MEDILINE T&T vor. Serialisierungs-, Tamper-Evident- und Kontrollwäge-Anforderungen lassen sich damit in einem einzigen, Workflow-optimierten Arbeitsschritt lösen. Kontrollwaage und Tamper-Evident-Etikettierer sind bei Bedarf gleich eingebaut. Die integrierte Schnittstelle zur Software MEDTRACKER erlaubt es, befüllte Faltschachteln prozesssicher zu serialisieren. Eine neuartige Schnellwechseleinrichtung erlaubt es, die Position der Kamera- und Druckeinheit werkzeuglos und ohne den Einsatz weiterer Komponenten mit wenigen Handgriffen in Minutenschnelle zu ändern. Die MEDILINE T&T, bestückt mit einem kartuschenbasierten Drucksystem, erreicht eine Produktionsgeschwindigkeit von bis zu 350 Faltschachteln pro Minute bei einer Druckauflösung von 600 dpi. Die Prüfkamera und Sensoren ... -
Etikettieranlage
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 129 (2017))
Etikettieranlage / Produkte
Gleich 4 Alpha HSM Etikettenspender sitzen in der Etikettieranlage Geset 314 ZDT von Bluhm *) . Nachdem die Anlage erstmals auf der Fachpack 2016 zu sehen war, wurde sie komplett überarbeitet und ist nun noch leistungsfähiger. ZDT steht für Zero Downtime und bedeutet, dass die Etikettenrollen während des laufenden Betriebs nachgelegt werden können. Alternativ können 2 der Etikettierer auch für das zusätzliche Aufbringen von Marketing-Etiketten genutzt werden. Am Ende des Etikettiervorganges prüft ein Vision-System das Vorhandensein und die Lage des Etiketts. Besonderes Highlight: Um Fehleingaben zu vermeiden, verfügt die neue Geset 314 ZDT über eine digitale Anzeige mit Verbindung zur ... -
Verpackungsroboter
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 130 (2017))
Verpackungsroboter / Produkte
Der FAST picker TP80 von Stäubli *) ist für ultraschnelle Verpackungsapplikationen mit seiner Performance von über 200 Picks pro Minute erste Wahl. Nun präsentiert Stäubli die jüngsten Varianten dieser Maschine. Wählt man aus der langen Optionsliste die Features HE und H1, ergibt sich daraus der perfekte Highspeed-Roboter für anspruchsvolle Einsätze in der Pharmaindustrie. HE steht dabei für Humid Environment und kennzeichnet die Modelle, die für den Einsatz in Feuchträumen oder unter Spritzwasserbeaufschlagung speziell modifiziert sind. Sie kommen bevorzugt bei Applikationen unter höchsten Hygienestandards zum Einsatz, bei denen die Roboter täglich anfallenden Reinigungsprozessen mit wässrigen Medien unterzogen werden. Nicht weniger ... -
Schneidmühlen
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 131 (2017))
Schneidmühlen / Produkte
Die Fritsch *) -Schneidmühle Pulverisette 19 aus rostfreiem Stahl 316L zerkleinert weiche bis mittelharte, zäh-elastische und faserige Materialien. Die Proben werden durch Schnitt und Scherung zerkleinert, die Siebkassette bestimmt die gewünschte Feinheit. Verschiedene Messergeometrien und austauschbare Schneiden sorgen für Flexibilität und Haltbarkeit. Die Mühle ist speziell für den analytischen Bereich konzipiert und besonders beständig gegen korrosive Medien wie Laugen und Säuren, speziell aber gegenüber chloridhaltigen Medien. Der Hochleistungszyklon zur optimalen Probenabsaugung ist mit einer Vielzahl einsetzbarer Reinigungsmittel besonders einfach rückstandsfrei zu reinigen. Dabei lässt er sich aufgrund seiner vollständigen Zerlegbarkeit völlig entleeren, überströmen und sterilisieren. Es besteht ein sicherer Schutz gegen ... -
Echtzeitkeimzähler
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 129 (2017))
Echtzeitkeimzähler / Produkte
Mit dem IMD-W von PMT *) lassen sich mikrobielle Verunreinigungen von Pharmawasser online überwachen, sowohl durch kontinuierliche Analysen an Reinstwasseranlagen, als auch durch Vermessung einzelner Wasserproben. Die Zählungen der mikrobiologischen Verunreinigungen im Reinstwasser (Biocounts) basieren auf dem Nachweisverfahren für fluoreszenzbasierte Luftkeimzählung. Eine Diskriminierung falsch-positiver Befunde geschieht aktiv über die Analyse mehrerer Fluoreszenzbänder. Neben dem Monitoring von Biocounts erfolgt die Erfassung der konventionellen, elastischen Mie-Lichtstreuung. Daher zeigt der IMD-W auch die nicht biologische Partikelzählrate an. -
Füll- und Verschließmaschine
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 130 (2017))
Füll- und Verschließmaschine / Produkte
Für das Füllen und Verschließen flüssiger Pharmazeutika im Produktionsmaßstab zeigt die Sparte Packaging Technology der Robert Bosch GmbH *) auf der interpack 2017 erstmals die ALF 5000 in der Vial-Ausführung. Bislang konnten Kunden entweder ausschließlich Ampullen oder Vials und Ampullen auf einer Maschine befüllen. Jetzt ist die bewährte ALF-Plattform auch als Stand-alone-Variante für die Vialabfüllung verfügbar. Die auf der interpack ausgestellte Maschine verfügt über 100 % In-Prozess-Kontrolle und einen tragenden Rechentransport. Dieser sorgt für ein noch schonenderes Handling der Behältnisse. Die ALF 5000 erzielt eine Ausbringung von bis zu 600 Behältnissen pro Minute und lässt sich mit verschiedenen Barrieresystemen kombinieren ... -
Rundum-Etikettieranlage
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 131 (2017))
Rundum-Etikettieranlage / Produkte
Die kompakte Rundum-Etikettieranlage 152E von HERMA *) deckt ein breites Spektrum an Produktdimensionen ab, lässt sich jedoch z. B. von vornherein mit einer kompletten Pharma-Ausstattung versehen. Dazu gehören z. B. Module für den variablen Datendruck, für die Kontrolle von Aufdrucken und Codes bzw. für die Etikettenanwesenheit sowie für einen entsprechenden Auswurf. Die Version mit Etiketten-Anrollband kommt gänzlich ohne Formatsätze aus. Daraus resultieren nicht nur besonders kurze Rüstzeiten, sondern auch eine beachtliche Leistung von bis zu 100 Produkten pro Minute. Bei der Version mit Rollenprisma lässt sich eine höhere Präzision erzielen. In dieser Variante kommt die Anlage auf etwa 90 Produkte pro ... -
Resthärtemessgerät
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 130 (2017))
Resthärtemessgerät / Produkte
BWT Pharma & Biotech *) führt das Resthärtemessgerät AQU@Sense auf dem Markt ein. Durch den Verzicht auf Reagenzien ist es eine einfache und wartungsarme Alternative zu anderen auf Titration basierenden Resthärtemesssystemen. Im einfachen Betriebsmodus misst das Gerät zyklisch die Resthärte und schaltet bei Überschreitung eines einstellbaren Grenzwerts einen potenzialfreien Kontakt. Im erweiterten Betriebsmodus werden 2 Messstellen überwacht. Mit der Automatisierung ist die qualitätsgesteuerte Regeneration von 2 Enthärtersäulen möglich: Der AQU@Sense erfasst die Erschöpfung des Arbeitsfilters und schaltet für die externe Steuerung einen Kontakt. Diese wechselt die Enthärtersäule samt Messpunkt und startet die Regeneration. Diese kapazitätsgesteuerte Regeneration ist so sicher ... -
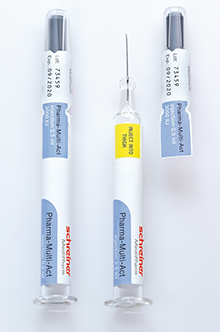
Spritzenlabel
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 129 (2017))
Spritzenlabel / Produkte
Schreiner MediPharm *) hat eine neuartige Kennzeichnungslösung für Spritzen entwickelt: Pharma-Multi-Act. Das Besondere: Eine ins Kennzeichnungslabel integrierte, mit einer Perforation versehene Lasche endet auf der Spritzenkappe. Öffnet man die Kappe, wird der Erstöffnungsschutz des Labels automatisch entlang der Perforation ausgelöst. Dadurch erfolgt die Öffnung des Etiketts und des Gefäßes gleichzeitig mit einer Handbewegung, ohne dass ein weiterer Schritt zur Entfernung des Siegels notwendig ist. Durch den Öffnungsprozess entsteht ein leicht zugängliches, abnehmbares Dokumentationsteil auf der Kappe, das selbst mit Handschuhen einfach abzulösen ist. Die Fläche unterhalb des abnehmbaren Teils kann zudem als Indikatorfeld für unterschiedlichste Funktionen genutzt werden. Dies ... -
GMP-Reinraumsysteme
Rubrik: Produkte
(Treffer aus TechnoPharm, Nr. 02, Seite 128 (2017))
GMP-Reinraumsysteme / Produkte
Das GMP-Reinraumsystem CleanSteriCell® von SCHILLING ENGINEERING *) wurde für den Produkt- und Personenschutz in der Pharmaproduktion entwickelt. Die innovativen Reinräume und Reinraumlabore sind modular aufgebaut und können dank der silikonfreien GMP-Dicht-Clip-Verbindung flexibel erweitert und umgebaut werden. Eine Umluftführung innerhalb der Reinraumwände, die die bereits gekühlte und gefilterte Luft erneut in den Kreislauf führt, und der Einsatz von sehr wartungsarmen ULPA-U15-Hochleistungsfiltern sorgen für hohe Sicherheit bei reduziertem Energieverbrauch. Neu entwickelt wurden GMP-konforme LED-Lichtbänder innerhalb der Aluminiumprofile, die eine ausgewogene und sparsame Beleuchtung sicherstellen. Über das bedienerfreundliche Kontrollsystem CR_Control®, das über einen zentralen Touchscreen und auch per App mobil gesteuert werden ...
Sie sehen Artikel 7491 bis 7500 von insgesamt 11884
- Erste Seite
- 748
- 749
- 750
- 751
- 752
- Letzte Seite