Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11884 Beiträge für Sie gefunden
-
Temperaturüberwachung mit BLE-Tags
Rubrik: Produkte
(Treffer aus pharmind, Nr. 02, Seite 190 (2025))
Temperaturüberwachung mit BLE-Tags / Produkte
Arealcontrol bietet eine Lösung zur Überwachung für temperaturgeführte Transporte mit Bluetooth Low Energy(BLE)-Tags an. Diese Sensoren ermöglichen die Erfassung von Temperaturdaten in Echtzeit, die drahtlos an ein zentrales System übertragen werden. Anwender können jederzeit auf aktuelle Temperaturwerte zugreifen, um sicherzustellen, dass die Ware unter optimalen Bedingungen transportiert wird. Die BLE-Tags sind einfach zu installieren und bieten eine hohe Präzision. Sie sind nach DIN/EN 12830 zertifiziert und bieten eine lückenlose Dokumentation und Überwachung der Temperaturen. Die Lösung basiert auf einer privaten Cloud, die den einfachen Zugriff auf die Daten ermöglicht. Laut Hersteller können Logistiker mit diesen Tags neue Maßstäbe in der Temperaturüberwachung ... -
Datenlogger
Rubrik: Produkte
(Treffer aus cleanroom & processes, Nr. 02, Seite 101 (2025))
Datenlogger / Produkte
CIK Solutions hat die DataTrace MPRF-Funkdatenlogger aus Edelstahl vorgestellt. Diese werden in der Pharma- und Lebensmittelindustrie zur Überwachung von Temperatur, Feuchte und Druck eingesetzt. Sie ermöglichen die Datenerfassung in Echtzeit, auch in geschlossenen Umgebungen wie Autoklaven. Die zugehörige Software DataTrace Pro (DT Pro) unterstützt die Konfiguration und Überwachung der Logger und erfüllt GMP- und FDA-Richtlinien. Laut Hersteller eignen sich die Logger für Anwendungen wie Sterilisations- und Prozessvalidierung, Depyrogenation und Stabilitätsprüfungen. Die Technologie trägt zur Qualitätssicherung und Einhaltung regulatorischer Anforderungen bei. www.cik-solutions.com -
Caverion übernimmt Schulz Lufttechnik
Rubrik: Personen
(Treffer aus cleanroom & processes, Nr. 02, Seite 99 (2025))
Caverion übernimmt Schulz Lufttechnik / Personen | Unternehmen
Caverion Deutschland hat am 4. Apr. die Schulz Lufttechnik GmbH übernommen. Das in Sprockhövel, Nordrhein-Westfalen, ansässige Unternehmen verfügt über mehr als 30 Mitarbeiter und bietet umfassende Lösungen in den Bereichen Lüftungs-, Klima-, Kälte-, Filter- und Reinraumtechnik an. Mit dieser Übernahme verfolgt Caverion Deutschland das Ziel, seine Position insbesondere im Bereich Reinraumtechnik weiter zu stärken und seine Wachstumsstrategie konsequent fortzusetzen. Schulz Lufttechnik wird als eigenständiges Unternehmen innerhalb von Caverion Deutschland geführt, wobei Dr. Arndt Schulz weiterhin als Geschäftsführer operativ tätig bleibt. Das familiengeführte Unternehmen erwirtschaftete zuletzt einen Jahresumsatz von über 5,5 Mio. Euro. Caverion sieht durch den Erwerb der Schulz Lufttechnik GmbH zahlreiche Synergien ... -
Hygienepumpen
Rubrik: Produkte
(Treffer aus cleanroom & processes, Nr. 02, Seite 101 (2025))
Hygienepumpen / Produkte
Die Askia GmbH bietet in ihrem Produktportfolio Hygienepumpen von Viking Pump aus Großbritannien an. Dabei übernimmt Askia Vertrieb, Kundenbetreuung und Service für die schonenden, scherarmen Flüssigkeitspumpen exklusiv für Deutschland. Die Hygienepumpen bieten passgenaue Lösungen für Anwendungen in der Pharmaindustrie sowie allen Anwendungen mit scherempfindlichen und hygienisch sensiblen Prozessmedien. Je nach Variante sind mit den hochspezialisierten Dreh- und Kreiskolbenpumpen Förderleistungen bis 189 m 3 /h und Drücke bis 34 bar für Medien mit einer Viskosität bis 200 000 Centistokes bei Temperaturen bis 180 °C erreichbar. Totraumfreie Ventildesigns ermöglichen ein effektives Reinigen der Pumpen, bei CIP- und SIP-fähigen Varianten sogar ohne Demontage aus der Rohrleitung. www.askiagmbh.de ... -
Kritische Infrastruktur? Ja bitte – aber inklusive Pharma!
Rubrik: Editorial
(Treffer aus Tech4Pharma, Nr. 03, Seite 129 (2025))
Kritische Infrastruktur? Ja bitte – aber inklusive Pharma! / Editorial
Sehr geehrte Leserinnen und Leser, um an der Macht zu bleiben (und russisches Supermachtstreben zu bedienen), braucht der russische Präsident bzw. Diktator Wladimir Putin offensichtlich einen äußeren Feind. Als diesen hat er den demokratischen Westen auserkoren. Es mehren sich die – sagen wir mal – zumindest unfreundlichen Maßnahmen gegenüber diesem: Es wird spioniert, sabotiert, herausgefordert. Direkte Nachbarn (sofern sie nicht wie Belarus reine Vasallenstaaten sind) berichten seit Jahren auch von Angriffen auf sich und warnen vor Krieg. Vor diesem Hintergrund ist die EU nicht nur dabei, ihr Militär zu ertüchtigen, sondern auch andere kritische Sicherheitsinfrastrukturen – u. a. die Medikamentenversorgung. Im ... -
Raumfahrt verändert Zeitrechnung im Reinraumbau
Rubrik: Ausstattung
(Treffer aus cleanroom & processes, Nr. 03, Seite 106 (2025))
Raumfahrt verändert Zeitrechnung im Reinraumbau / ISO 5 Reinraum für Weltraumteleskop in nur 5 Tagen realisiert · Merkle S, Müller A · Merkle CAE Solutions und OHB System
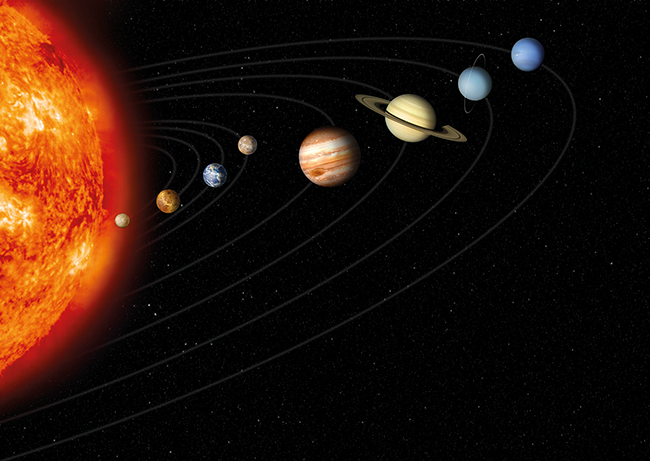
Reinraum Raumfahrt ISO 5 Simulation Geschwindigkeit Planetary Transits and Oscillations of Stars (PLATO) ist ein Weltraumteleskop und die 3. mittelgroße Mission (engl. Medium-class mission, M3) im Rahmen des Cosmic Vision Programms der Europäischen Weltraumorganisation (ESA). PLATO sucht nach extrasolaren Planeten, die etwa die Größe der Erde haben und sonnenähnliche Sterne innerhalb eines Jahres umkreisen. Abbildung 1 zeigt das hiesige Sonnensystem mit den Größenverhältnissen der Planeten. Die PLATO-Mission soll u. a. folgende Fragen beantworten: Wie entstehen und entwickeln sich Planeten und Planetensysteme? Ist das hiesige Sonnensystem ein Sonderfall? Gibt es andere Planeten, die lebensfreundliche Bedingungen bieten? Solche Planeten kann PLATO entdecken, wenn sie vor ...
-
Hoffnungsträger im Kleinstformat
Rubrik: Editorial
(Treffer aus cleanroom & processes, Nr. 03, Seite 103 (2025))
Hoffnungsträger im Kleinstformat / Editorial
Liebe Leserinnen und Leser, während die gesamtdeutsche Wirtschaft stagniert oder gar ein Negativwachstum aufweist, kommen in letzter Zeit vermehrt positive Nachrichten aus dem Osten der Republik. Die Rede ist von Dresden. Die in Teilen pittoreske Stadt an der Elbe zieht nicht nur mit imposanten Bauten wie dem Zwinger, der Semperoper und der Frauenkirche jährlich Millionen von Touristen an, sondern hat sich auch zum deutschen Mikrochip-Hotspot gemausert. Das Silicon Saxony genannte und massiv von der Bundesregierung subventionierte Industriegebiet erlebt gerade einen starken Aufschwung. Sage und schriebe 5 Mrd. Euro investiert dort der Münchner Chiphersteller Infineon in den Ausbau seiner Smart Power Fab, ... -
Kamerageführte Robotik
Rubrik: Automation
(Treffer aus Tech4Pharma, Nr. 03, Seite 132 (2025))
Kamerageführte Robotik / Teil 1: Der Schlüssel zur flexiblen Pharmaproduktion · Purwin R · Optonic
Pharmaproduktion Kamerageführte Robotik 3-D-Kamera Bin-Picking Prozessautomatisierung Der Umbruch in der pharmazeutischen Produktion – hin zu kleineren Produktionslosen bei gleichzeitig größerer Produktvielfalt durch Individualisierung – erfordert eine drastische Anpassung der Produktionsprozesse und -mittel. Wie in anderen industriellen Sektoren auch kommt dem Einsatz von Robotern dabei eine zunehmende Bedeutung zu. Denn Roboter bringen bei einer kleinskaligen Produktion mehr Flexibilität in Handling-Prozesse und vermindern dadurch den Aufwand für die Umrüstung beim Produktwechsel erheblich. Richtig erfolgreich ist die Integration von robotischen Handling-Systemen allerdings nur, wenn auch an anderen Stellen im Produktionsprozess Optimierungen vorgenommen werden. Außerdem müssen die Roboter auf Basis von Bilderkennung und adaptiven ...
-
30 Jahre GMP-Konferenz
Rubrik: Gastkommentar
(Treffer aus pharmind, Nr. 03, Seite 200 (2025))
30 Jahre GMP-Konferenz / Ein Blick in die Zukunft der Pharmaindustrie · Brown M, Schnettler R · PTS Training Service
GMP-Konferenz Digitalisierung Künstliche Intelligenz EU-Arzneimittelgesetzgebung Nachhaltigkeit Nach der offiziellen Begrüßung durch Reinhard Schnettler und Anna Diehl ( Abb. 1 ) von PTS Training Service eröffnete Dr. Christoph Bug von Veeva Systems die Konferenz mit einem fundierten Vortrag zur digitalen Transformation der Pharmaindustrie. Er skizzierte die Entwicklungen in der Informationstechnologie und deren Auswirkungen auf die Branche. Ein zentraler Punkt war die Rolle von KI und Cloud-Lösungen, um Effizienz und Produktivität zu steigern. Dr. Bug stellte fest, dass die Geschwindigkeit der technologischen Entwicklung, insbesondere bei KI, zu einem Paradigmenwechsel führt. Anhand von Beispielen zeigte er, wie datenbasierte Entscheidungen und Automatisierung helfen können, Ineffizienzen zu ...
-
Quantencomputer
Rubrik: Exkurs
(Treffer aus pharmind, Nr. 03, Seite 196 (2025))
Quantencomputer / Stoll | Quantencomputer · Stoll G
Physik Quantenmechanik Qubit Ionenfallen Supraleitung Man hat die Wahl. Die klassische Variante: Sobald man nachschaut, ist Schrödingers Katze tot. Oder sie lebt. Die moderne Variante: Sie lebt, sie ist tot, aber es gibt sie auch in unendlichen Ausführungen dazwischen, mal mit einem höheren toten Anteil, mal mit einem geringeren. Quantenmechanik ist unanschaulich und kontraintuitiv und es gibt Stimmen, die sogar behaupten, wer sie tatsächlich zu verstehen glaube, habe sie vielmehr gar nicht verstanden. Erwin Schrödinger (1887–1961; Nobelpreis für Physik 1933) publizierte 1935 eine Aufsatzreihe über die Quantenmechanik [ 1 ], in der er zeigen wollte, dass man quantenmechanische Vorstellungen nicht auf makromolekulare Gebilde ...
Sie sehen Artikel 11611 bis 11620 von insgesamt 11884
- Erste Seite
- 1160
- 1161
- 1162
- 1163
- 1164
- Letzte Seite