Ihr Suchergebnis
Sie recherchieren derzeit unangemeldet.Melden Sie sich an (Login) um den vollen Funktionsumfang der Datenbank nutzen zu können.
In der Rubrik Zeitschriften haben wir 11970 Beiträge für Sie gefunden
-
Automatisierte Qualitätskontrolle pharmazeutischer Packmittel
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 02, Seite 120 (2020))
Automatisierte Qualitätskontrolle pharmazeutischer Packmittel / Spektrum
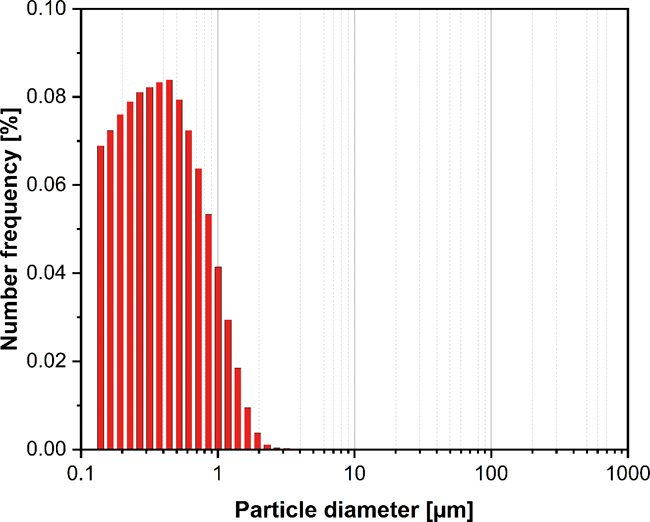
Die Überprüfung von Inhalten und die Sicherstellung der Druckqualität pharmazeutischer Packmittel sind essenziell. Die strengen normativen und gesetzlichen Anforderungen innerhalb der Pharmabranche setzen dabei eine große Expertise in den Bereichen Datenintegrität und Manipulationssicherheit der Produktions- und Verarbeitungsprozesse voraus. Druckbildkontrollsysteme unterstützen Pharmazeuten bei der Vermeidung benutzerseitiger Prozesseingriffe und der Sicherstellung hoher Qualitätsstandards mithilfe automatisierter Prüfungen und flexibler Systemintegrationen. Potenzielle Fehlerquellen können bei der Produktion und Weiterverarbeitung pharmazeutischer Druckerzeugnisse – z. B. Beipackzettel, Verpackungen und Etiketten – über verschiedene Prozessschritte hinweg entstehen. Dabei haben unleserliche, falsche oder unvollständige Informationen teils lebensgefährliche Folgen für Patienten. Aus diesem Grund sehen sich Pharmazeuten hohen Haftungsrisiken und ... -
Hocheffiziente und sichere Sterilitätstests
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 02, Seite 118 (2020))
Hocheffiziente und sichere Sterilitätstests / Spektrum
Mehr Einsatzzeit und höchste pharmazeutische Sicherheit bietet eine neue Generation Sterilitätstestisolatoren. Dafür verantwortlich ist DECOpulse®, ein hocheffizientes und prämiertes Bio-Dekontaminationssystem. Der Sterilitätstestisolator von Metall+Plastic weist zudem einen ergonomischen Aufbau sowie das Plug & Test-Prinzip auf. Ein physikalisches Phänomen lieferte die grundlegende Idee, um DECOpulse® realisieren zu können: Auch bei Raumtemperatur kann H 2 O 2 verdampfen, wenn der Druck in der flüssigen Phase groß genug ist. Da die geometrische Form durch die Oberflächenspannung einen Einfluss auf den inneren Druck hat, wäre hier eine Tröpfchen- bzw. Kugelform des H 2 O 2 in Mikrogröße geeignet. Entsprechend der Young-LaPlace-Gleichung muss der ... -
High-Shear-Granulations-/Wirbelschichttrocknungsprozess vs. Eintopfgranulierprozess
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 02, Seite 116 (2020))
High-Shear-Granulations-/Wirbelschichttrocknungsprozess vs. Eintopfgranulierprozess / Spektrum
Die Feuchtgranulation via High-Shear-Granulierer und anschließender Trocknung in der Wirbelschicht ist heute eine der wichtigsten Technologien im pharmazeutischen Umfeld. Der Eintopfprozess bietet eine alternative Technologie. Dieser ermöglicht, mit gleicher Effizienz und geringerem Platzbedarf die hohen Anforderungen zu erfüllen. Seit geraumer Zeit gehört die Feuchtgranulierung via High-Shear-Granulierer und daran anknüpfender Trocknung im Wirbelschichtgerät zu den wichtigsten pharmazeutisch-technologischen Prozessschritten bei der Herstellung fester Arzneiformen. Die wesentlichen Gründe für eine Feuchtgranulierung sind vielseitig und beinhalten u. a. eine Verbesserung des Fließverhaltens und der Verpressbarkeit (Tabletten), das Verhindern von Entmischungen und die damit verbundene Homogenität der Wirkstoffverteilung [ 1 , 2 ]. Ein weiterer sehr ... -
Eine lange Erfolgsgeschichte in Sachen Trocknung
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 02, Seite 114 (2020))
Eine lange Erfolgsgeschichte in Sachen Trocknung / Spektrum
Ein renommiertes deutsches Pharmaunternehmen setzt seit Jahren auf die sog. Kondensationstrocknung mit Wärmepumpe . Mit dieser Anlagentechnik, die zwischenzeitlich in vielen Werken im In- und Ausland eingesetzt wird, wurden Prozesse in Sachen Trocknen und Kühlen optimiert. Bei einem neuen Projekt wollte der Hersteller von pharmazeutischen Produkten nun eine erweitere Technik in der kombinierten Trocken-Kühl-Anlage verbaut haben: Es sollte zusätzlich ein Reinigungsvorgang integriert werden. Dazu musste der Trocknungsanlagenbauer Harter, dessen Entwicklung die Kondensationstrocknung mit Wärmepumpe ist, die Konstruktion der Anlage entsprechend ändern. Die Ausgangssituation war folgende: Ampullen aus Kunststoff mit 5, 10 und 20 ml Inhalt werden mittels Heißwasserberieselung im Unterwasserverfahren sterilisiert. ... -

40 Jahre groninger
Rubrik: Spektrum
(Treffer aus TechnoPharm, Nr. 02, Seite 113 (2020))
40 Jahre groninger / Spektrum
„Aus Tradition innovativ – jetzt und in Zukunft“ – unter diesem Motto steht das Jahr 2020 bei der groninger & co. gmbh im baden-württembergischen Crailsheim. Das weltweit agierende Familienunternehmen baut Füll- und Verschließanlagen für die Pharma-, Kosmetik- und Consumer-Healthcare-Industrie. Es feiert in diesem Jahr seinen 40. Geburtstag und blickt damit auf 4 erfolgreiche Jahrzehnte zurück. Rückblick – Jan. 1980: Das neue Jahrzehnt ist erst wenige Tage alt, als Horst Groninger beim Skifahren eine Entscheidung trifft, die sein eigenes Leben, aber auch den deutschen Sondermaschinenbau nachhaltig verändern wird. Der damals 40-Jährige will sich im Bereich der Füll- und Verschließanlagen für die pharmazeutische Industrie selbstständig machen. ... -
Cyber Security by Design in der Anlagenplanung und -realisierung
Rubrik: IT
(Treffer aus TechnoPharm, Nr. 02, Seite 108 (2020))
Mettler H | Krausz S | Jebari A
Cyber Security by Design in der Anlagenplanung und -realisierung / Teil 1 · Mettler H, Krausz S, Jebari A · Exyte Central Europe, Stuttgart
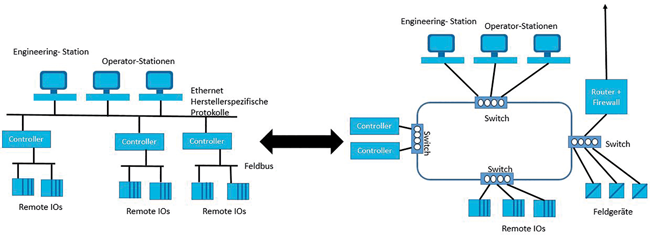
Cyber Security Security by Design Industrie 4.0 Informationssicherheitsmanagement Vorgehensmodelle In Planung und Betrieb automatisierter computergestützter verfahrenstechnischer Anlagen für die GxP-regulierte Life-Science-Industrie müssen sich neue Methoden der Anlagenplanung und des Anlagendesigns etablieren. Grund dafür sind die immer drängenderen Forderungen der globalen Märkte nach Schnelligkeit und Flexibilität mit immer kürzeren Entwicklungszeiten. Im Planungsprozess wird dadurch die frühzeitige Planung, das Design und die Integration vernetzter technischer Infrastrukturen und computergestützter Automatisierungslösungen immer wichtiger, insbesondere im Bereich der Produktion von Wirkstoffen für die maßgeschneiderten Pharmakotherapien (z. B. Personalisierte Medizin oder Gentherapien). Neue Anforderungen sind zudem die Planung und die Vernetzung von computergestützten Produktionsanlagen, die Datenverarbeitung und ...
-
Strömungsvisualisierung in der aseptischen Kernzone
Rubrik: Reinraum
(Treffer aus TechnoPharm, Nr. 02, Seite 102 (2020))
Strömungsvisualisierung in der aseptischen Kernzone / Teil 2*Teil 1 dieses Beitrags ist erschienen in TechnoPharm 10, Nr. 1 42-47 (2020). · Mathe G, Gavranovic C · Morgan Sindall Professional Services AG, Freiburg
Zur Erstellung des Drehbuchs sind die Punkte zum Rüsten der Anlage und auch die Interventionen grundsätzlich schnell zusammengestellt. Nun stellt sich noch die Frage, was wird bei den Punkten „At Rest“ und „In Operation“ eigentlich gezeigt? Dies lässt sich nicht so einfach beantworten. Die ISO 14644 liefert hier nur die Anforderung, dass die Lage der Punkte zur Strömungssichtbarmachung dokumentiert werden soll. Der FDA-Aseptic Guide liefert die Vorgabe, dass kritische Bereiche visualisiert werden sollen, um einen unidirektionalen Luftstrom über das Produkt und von diesem weg nachzuweisen. Zur Auswahl der kritischen Punkte zur Strömungssichtbarmachung bedient sich der Experte der Anforderungen aus der ICH Q9 ...
-
Important elements in continuous granule drying processes
Rubrik: Prozesstechnik
(Treffer aus TechnoPharm, Nr. 02, Seite 92 (2020))
Meier R | Emanuele D | Harbaum P
Important elements in continuous granule drying processes / Experiences from lab and production scale · Meier R, Emanuele D, Harbaum P · L.B. Bohle Maschinen + Verfahren GmbH, Ennigerloh (Germany)
continuous manufacturing twin-screw granulation QbCon continuous drying residence time distribution The Guidance on Process Analytical Technologies (PAT) of the U.S. Food and Drug Administration and the Guidelines Q8, Q9 and Q10 of the International Council for Harmonisation (ICH) on pharmaceutical development, quality-related risk management and quality systems many years ago have given the concept of continuous pharmaceutical manufacturing a major boost. After long implementation periods, nowadays there are several products on the US, EU and Japanese markets being produced by and registered as continuous manufacturing processes [ 1 ] – some of them by means of continuous wet granulation and ...
-
Mikrodosierung mittels vibrierender Kapillare
(Treffer aus TechnoPharm, Nr. 02, Seite 84 (2020))
Mikrodosierung mittels vibrierender Kapillare / Sternberger-Rützel • Mikrodosierung · Sternberger-Rützel E · Harro Höfliger Verpackungsmaschinen GmbH, Allmersbach i.T.
Mikrodosierung ab ca. 0,1 mg vibrierende Kapillare als Dosierprinzip 100%-Kontrolle der Dosierung verschiedene Produkte dosierbar hohe Präzision und Reproduzierbarkeit Um die Entwicklung von Medikamenten zu beschleunigen, gibt es in letzter Zeit die Anforderung, reinen Wirkstoff ohne Zusatz von Hilfsstoffen und ohne den Aufwand der galenischen Formulierung abzufüllen, z. B. in Kapseln für eine FirstInMen-Studie in Klinik-Phase I [ 1 ]. Da die Wirkstoffe immer potenter werden, handelt es sich oft um Mikrodosierungen mit Mengen um 1 mg; z. T. geht es aber auch um größere Dosierungen von mehreren hundert mg. Dafür benötigt man ein flexibles Dosiersystem, das viele verschiedene Pulver mit unterschiedlichen Eigenschaften mit hoher Präzision ...
-
Obligatorische Kennzeichnung von Arzneimitteln in Russland ab 2020
(Treffer aus TechnoPharm, Nr. 02, Seite 80 (2020))
Obligatorische Kennzeichnung von Arzneimitteln in Russland ab 2020 / Bin • Kennzeichnung in Russland · Bin A · Bluhm Systeme GmbH, Rheinbreitbach
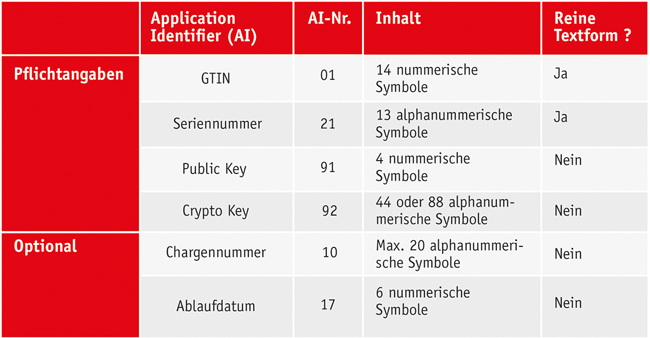
Serialisierung Kennzeichnung Data Matrix Code Rückverfolgbarkeit Kryptographie Eines der Probleme des russischen Marktes ist der hohe Anteil illegaler Handelsprodukte, der in einigen Bereichen des Handels 50 % erreicht. Um dieses Problem konkret anzugehen, beschloss die Regierung 2017, ein nationales System zur Kennzeichnung und Rückverfolgbarkeit von Waren zu schaffen, das die Bezeichnung „Chestny Znak“ – wörtlich übersetzt „Ehrliches Zeichen“ – bekommen hat. Das neue System ermöglicht es, alle Informationen zum Hersteller, zur Herkunft des Produktes sowie über Ort, Datum und Uhrzeit der Produktion zu erhalten. Ein spezielles Kennzeichnungsverfahren reduziert die Verbreitung aller Arten illegaler Produkte. Als Systembetreiber wurde das russische Zentrum für ...
Sie sehen Artikel 2821 bis 2830 von insgesamt 11970
- Erste Seite
- 281
- 282
- 283
- 284
- 285
- Letzte Seite