Brustkrebs: Bei der Versorgung ist Luft nach oben
27.02.202670.000 Frauen erhalten in Deutschland die Diagnose Brustkrebs. Das ist eine Neudiagnose alle sieben bis acht Minuten. Während die Versorgung in Deutschland im internationalen Vergleich als gut gilt, ...
Universitätsmedizin Mainz als Referenzzentrum für Seltene Erkrankungen zertifiziert
26.02.2026Das Zentrum für Seltene Erkrankungen (ZSE) der Universitätsmedizin Mainz (UM) ist nach den anspruchsvollen Qualitätskriterien des Nationalen Aktionsbündnisses für Menschen mit Seltenen ...
BioPark Regensburg - Geschäftsbericht 2025
25.02.2026Die aktuelle Entwicklung des Clusters zeigt eine leichte Zunahme der Firmen und Mitarbeiterzahlen in einem schwierigen Umfeld der aktuellen nationalen und globalen Wirtschaftsentwicklung auf. Die von ...
Präklinische Forschung an seltenen, früh auftretenden Erkrankungen bei Kindern
24.02.2026Im Rahmen der transnationalen Ausschreibung der European Rare Disease Research Alliance (ERDERA) zum Thema »Präklinische Therapiestudien für seltene Krankheiten unter Verwendung kleiner Moleküle ...
3D-Mikrotumoren können Therapieentscheidung revolutionieren
23.02.2026Bei fortgeschrittenem Darmkrebs ist eine Chemotherapie oft zentraler Bestandteil der Behandlung. Doch nicht jede Therapie wirkt bei jeder Patientin und jedem Patienten gleich gut. Forschende vom ...
meistgelesen

Beitrag aus der Ausgabe 10/2025 der Zeitschrift pharmind
KI in der Pharmazeutischen Industrie
Hype oder Organisationsaufgabe?
Hype oder Organisationsaufgabe? – Das ist natürlich eine rhetorische Frage. „Hype“ ist negativ konnotiert: Etwas, das rasch wieder vergeht und kaum Erinnerungen hinterlässt. Dies trifft auf Künstliche Intelligenz (KI) allerdings nicht zu. Den Begriff gibt es schon seit beinahe 80 Jahren. In dieser Zeit gab es verschiedene Phasen, die jeweils die öffentliche Diskussion befeuert haben. Es blieb jeweils auch etwas übrig, ...
Beitrag aus der Ausgabe 2/2025 der Zeitschrift Tech4Pharma
Temperaturverteilungsmessung
Herausforderungen bei einem Tieftemperatur-Mapping
Die Temperatur- und Klimaverteilungsmessung, kurz Mapping genannt, bildet das zentrale Element einer Lager- oder Transportqualifizierung. Im EU-Leitfaden zur Good Distribution Practice (GDP) [1] wird die Durchführung einer Verteilungsstudie vor Inbetriebnahme und bei wesentlichen Veränderungen unter repräsentativen Bedingungen gefordert. Die Basis dafür bildet eine entsprechende Risikobetrachtung. Näheres dazu kann in [2] nachgelesen ...
Beitrag aus der Ausgabe 3/2025 der Zeitschrift cleanroom & processes
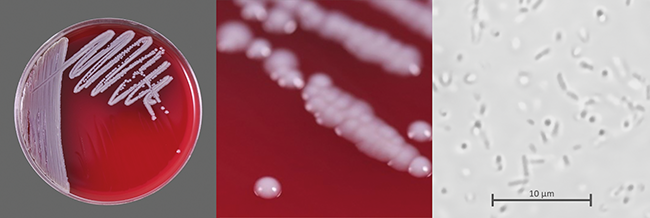
Filtergängige Bakterien
Risiko bei der aseptischen Herstellung
Die Sterilfiltration ist ein kritischer Prozess in der aseptischen Herstellung steriler Produkte, dessen Ziel die Entfernung von Mikroorganismen ist. Eine verbreitete Annahme ist, dass ein intakter Filter grundsätzlich alle Mikroorganismen zurückhält. Es gibt aber sehr wohl Mikroorganismen, die unter gewissen Umständen auch einen intakten und Pre-Use-Post-Sterilisation-Integrity-Testing(PUPSIT)-geprüften Filter passieren können. Biologische ...
Top Themen

Beitrag aus der Ausgabe 2/2026 der Zeitschrift pharmind
Reinmedienprojekte in der Pharmaindustrie
Warum die Validierungsdokumentation den entscheidenden Mehraufwand bedeutet
Die GMP-gerechte Planung und Umsetzung von Reinmedienanlagen in der pharmazeutischen Industrie erfordert ein umfassendes Validierungs- und Dokumentationsmanagement, das die regulatorischen Anforderungen von Beginn an berücksichtigt. Systeme zur Erzeugung und Distribution von Gereinigtem Wasser (Purified Water, PW) und Wasser für Injektionszwecke (Water for Injection; WFI) berühren das Produkt direkt und müssen daher sämtliche Spezifikationen ...

Beitrag aus der Ausgabe 4/2025 der Zeitschrift Tech4Pharma
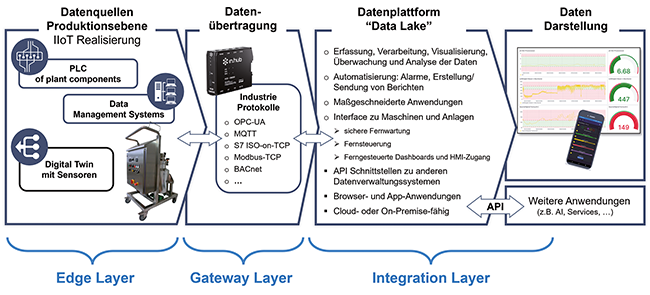
Modellbasierte Prozessoptimierung
Diskrete Ereignissimulation am Beispiel des Puffermanagements – Teil 1
Die biopharmazeutische Industrie durchläuft derzeit einen Transformationsprozess, der maßgeblich durch den Einsatz digitaler Technologien und datenbasierter Methoden geprägt ist. In diesem Wandel etabliert sich Simulation zunehmend als zentrales Instrument zur Analyse, Optimierung und strategischen Steuerung komplexer Produktionsabläufe [1].Ein vielzitierter Beitrag zur Diskussion um die „Fabrik der Zukunft“ stammt von ...

Beitrag aus der Ausgabe 4/2025 der Zeitschrift cleanroom & processes
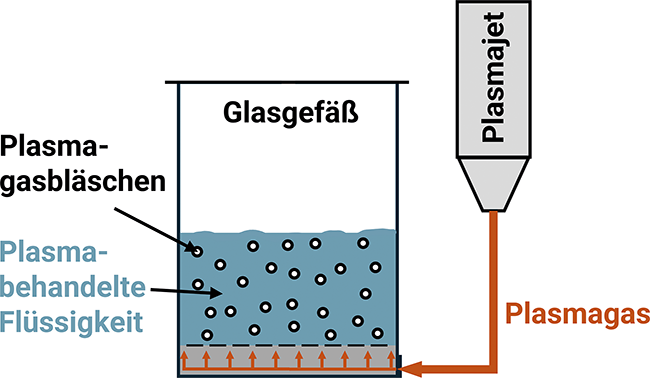
Plasmabehandelte Flüssigkeiten
Hygienische Reinigung anspruchsvoller Bauteile und Oberflächen
Reinräume sind speziell kontrollierte Umgebungen für die Entwicklung und Herstellung hochsensibler Produkte. Die Reinraumumgebung ermöglicht die Einhaltung regulatorischer Anforderungen und effiziente Herstellungsprozesse. Durch den Reinraum werden Umgebungsbedingungen geschaffen, indem das Kontaminationsrisiko für Produkte durch Prozesse und Produktlogistik minimiert wird. Entscheidende Bedeutung haben Reinräume in Branchen wie der ...

Vorschau (Änderungen vorbehalten)
Beitrag aus der nächsten Ausgabe 3/2026 der Zeitschrift pharmind
(erscheint am 31.03.2026)
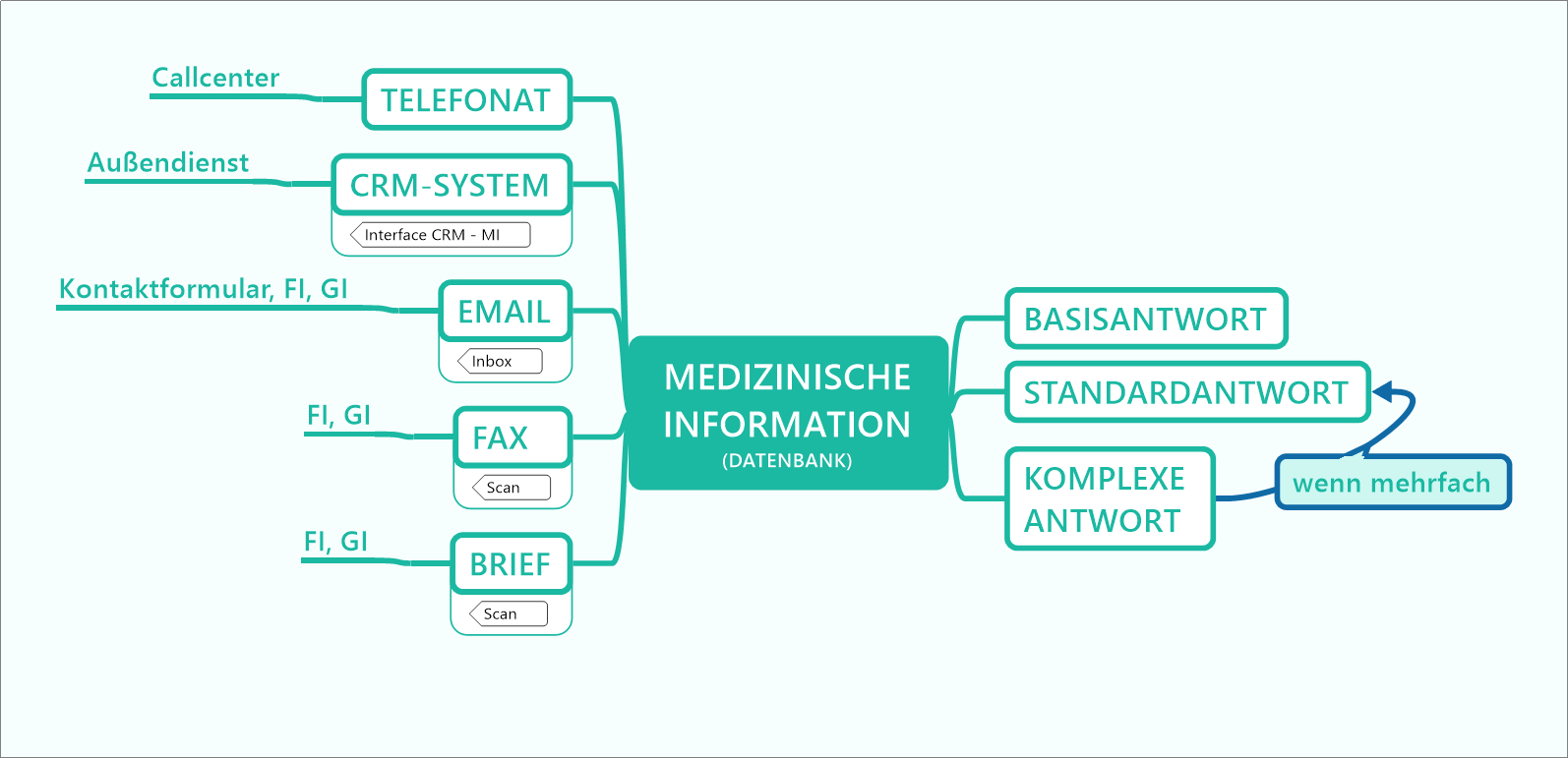
Standard Reference Documents per Online-Recherche | Dokumententyp für den erweiterten Wissenstransfer an Heilberufler
Standard Reference Documents (SRDs) sind ein in vielen Pharmaunternehmen etablierter Dokumententyp, mithilfe dessen vertiefte Anfragen von Heilberuflern beantwortet werden. Dieser Dokumententyp kann nun über die etablierten Kommunikationskanäle wie Telefon, E-Mail, Außendienst oder Post hinaus auch über einen digitalen Kanal angeboten werden. Damit kann eine asynchrone Informationsbeschaffung, also ohne die unmittelbare Weitergabe der Information durch einen Mitarbeiter, umgesetzt werden. Arzneimittelkompendien sind eine ideale Schnittstelle für die digitale Anbindung dieses Dokumententyps als niederschwelliges Instrument für den digitalen Wissenstransfer zwischen Pharmaindustrie und Heilberuflern und dienen damit der Sicherstellung der Arzneimitteltherapiesicherheit.


Beitrag aus der nächsten Ausgabe 1/2026 der Zeitschrift Tech4Pharma
(erscheint am 11.03.2026)
Systemintegration als Schlüssel / Sicheres und effizientes Containment in der pharmazeutischen Feststoffproduktion
Die Pharmaindustrie sieht sich mit stetig steigenden Anforderungen an Containment-Lösungen konfrontiert. Der Umgang mit hochpotenten Wirkstoffen, neue regulatorische Vorgaben und die Entwicklung immer komplexerer Produktionssysteme verlangen nach innovativen, ganzheitlich integrierten Konzepten zum Schutz von Bedienern, Produkten und Umwelt – bei gleichzeitig maximaler Effizienz. Besonders die Kombination von Continuous Manufacturing und digital vernetzter Prozessüberwachung mittels eingebetteter Prozessanalysetechnik (ePAT) setzt neue Maßstäbe für Sicherheit, Qualität und Wirtschaftlichkeit. Der aktualisierte SMEPAC-Praxisleitfaden fokussiert sich erstmals explizit auf komplexe Anlagen und den gesamten Lebenszyklus – von der Produktion über Reinigung bis zur Außerbetriebnahme. Dieser Beitrag analysiert regulatorische Veränderungen, erläutert die Rolle von Systemintegration und Transferpunkt-Minimierung und gibt praxisnahe Einblicke in die Umsetzung neuer Leitlinien und innovativer Technologien.

Beitrag aus der nächsten Ausgabe 01/2026 der Zeitschrift cleanroom & processes
(erscheint am 17.03.2026)
Richtiges Ankleiden und Verhalten im Reinraum – Ein Schlüssel für die Produktqualität
Der Mensch stellt im Reinraum die größte Kontaminationsquelle in sensiblen Branchen wie Pharma-, Halbleiter- oder Medizintechnikproduktion dar. Geschulte Mitarbeiter tragen täglich eine große Verantwortung für die Einhaltung der richtigen Ankleideprozedur sowie für das korrekte Verhalten im Reinraum. Ein geeignetes Bekleidungskonzept kann über Messungen der Partikelwerte mittels Body Box erfasst werden und stellt die Grundlage für eine mögliche Leistungsqualifizierung dar.
Neben dem korrekten Ankleiden ist das richtige Verhalten von enormer Bedeutung, um Risiken zu minimieren. Durch regelmäßige Schulungen, klare Verfahrensanweisungen und dem konsequenten Streben nach Verbesserungen kann dauerhaft eine qualitativ hochwertige Produktion sichergestellt werden.